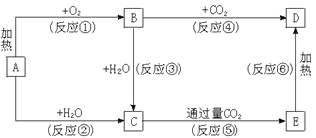
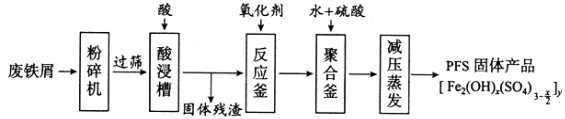
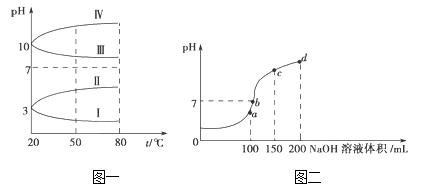
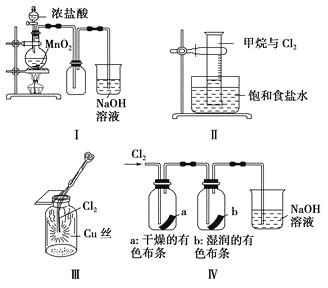
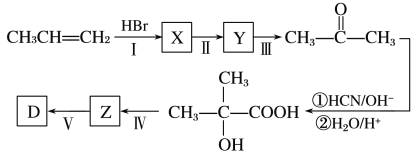
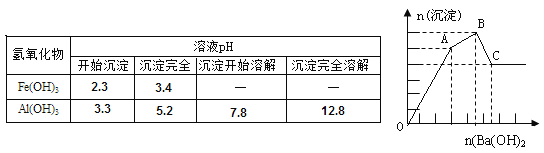
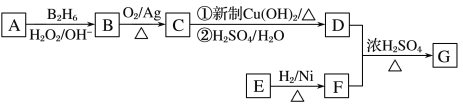题目内容
【题目】氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制的流程。
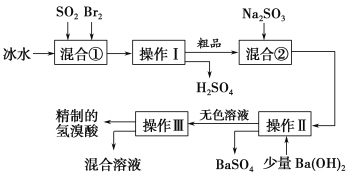
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为________________________________。
(2)混合①中使用冰水的目的是________________________________。
(3)操作Ⅱ和操作Ⅲ的名称分别是________、________。
(4)混合液②中加入Na2SO3的目的是_________________________________。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)常带有淡淡的黄色。于是甲、乙两同学设计了简单实验加以探究:甲同学假设工业氢溴酸呈淡黄色是因为含有Fe3+,则用于证明该假设所用的试剂为________,若假设成立可观察的现象为___________。乙同学假设工业氢溴酸呈淡黄色是因为________________________,其用于证明该假设所用的试剂为________。
【答案】(1)SO2+Br2+2H2O===H2SO4+2HBr (2)降低体系温度,防止溴挥发,使反应进行完全
(3)过滤 , 蒸馏 (4)除去粗产品中未反应完的溴
(5)KSCN溶液,溶液变成血红色,含有Br2,CCl4(其他合理答案也可以
【解析】
试题分析:(1)Br2具有强氧化性,在溶液中将SO2氧化为H2SO4,自身被还原为HBr,反应的化学方程式为SO2+Br2+2H2O===H2SO4+2HBr。
(2)Br2氧化SO2放出很多热量,溴易挥发,使用冰水,降低体系温度,防止溴蒸发,使反应完全;÷(3)由工艺流程可知,操作Ⅱ分离固体与液体,应是过滤;操作Ⅲ为互溶的溶液组分的分离,应是蒸馏。蒸馏一般适用与互溶的液体的分离;
(4)粗品中可能含有为反应的Br2,加入Na2SO3,亚硫酸钠具有还原性,可以除去粗品中未反应完的溴;(5)用KSCN溶液检验Fe3+,取少许溶液滴加KSCN溶液,溶液变成血红色,说明氢溴酸呈淡黄色是因为含Fe3+。由工艺流程可知,溶液中可能含有Br2,可以用CCl4萃取方法检验,取少许溶液加振荡、静置分层,下层呈橙红色,说明氢溴酸呈淡黄色是因为含Br2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案