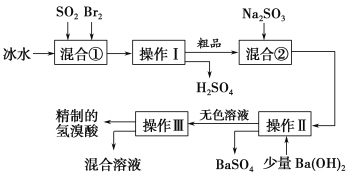
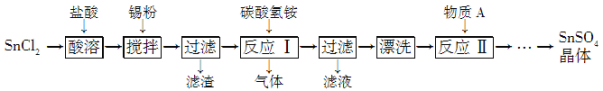题目内容
【题目】[化学——选修2:化学与技术]聚合硫酸铁(PFS)是谁处理中重要的絮凝剂,下图是以回收废铁屑为原料制备PFS的一种工艺流程。
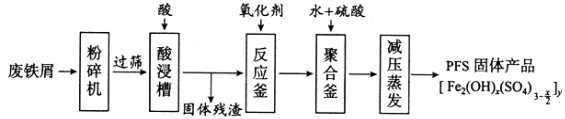
回答下列问题
(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为_________。粉碎过筛的目的是_______
(2)酸浸时最合适的酸是_____,写出铁锈与酸反应的离子方程式_____________________。
(3)反应釜中加入氧化剂的作用是_________,下列氧化剂中最合适的是____________(填标号)。
A.KMnO4 B.![]() C.
C.![]() D.
D.![]()
(4)聚合釜中溶液的pH必须控制在一定的范围内,pH偏小时Fe3+水解程度弱,pH偏大时则_______。
(5)相对于常压蒸发,减压蒸发的优点是______。
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,定义式为![]() (n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c
(n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c![]() 的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液V mL。按照上述步骤做空白对照试验,消耗NaOH溶液
的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液V mL。按照上述步骤做空白对照试验,消耗NaOH溶液![]() ,已知该样品中Fe的质量分数w,则B的表达式为__________
,已知该样品中Fe的质量分数w,则B的表达式为__________
【答案】(1)Fe2O3·xH2O;选取细小颗粒,增大反应物接触面积,提高“酸浸”反应速率 ;(2)硫酸Fe2O3·xH2O+6H+=2Fe3++3SO42-+(x+3)H2O;(3)氧化Fe2+ ,c ;(4)pH过大,容易生成Fe(OH)3,产率降低;(5)减压蒸馏,可防止温度过高,聚合硫酸铁分解 ;(6)![]() 。
。
【解析】
试题分析:(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为Fe2O3·xH2O 。粉碎过筛的目的是控制铁屑的颗粒。
(2)由于不能引入杂质,则酸浸时最合适的酸是硫酸,铁锈与酸反应的离子方程式为Fe2O3·xH2O+6H+=2Fe3++3SO42-+(x+3)H2O。
(3)由于溶液中含有亚铁离子,则反应釜中加入氧化剂的作用是氧化Fe2+,由于不能引入杂质,则氧化剂中最合适的是绿色氧化剂双氧水。
(4)聚合釜中溶液的pH必须控制在一定的范围内,pH偏小时![]() 水解程度弱,pH偏大时则Fe3+转化为氢氧化铁沉淀而损失,造成产率降低。
水解程度弱,pH偏大时则Fe3+转化为氢氧化铁沉淀而损失,造成产率降低。
(5)相对于常压蒸发,减压蒸发的优点是可防止温度过高,聚合硫酸铁分解。
(6)做空白对照试验,消耗NaOH溶液![]() ,说明与样品反应的盐酸的物质的量是(V0-V)c×10-3mol,所以样品中氢氧根的物质的量是(V0-V)c×10-3mol。已知该样品中Fe的质量分数w,则铁的物质的量是
,说明与样品反应的盐酸的物质的量是(V0-V)c×10-3mol,所以样品中氢氧根的物质的量是(V0-V)c×10-3mol。已知该样品中Fe的质量分数w,则铁的物质的量是![]() ,因此B的表达式为
,因此B的表达式为![]() =
=![]() 。
。

【题目】下表是元素周期表的一部分, 针对表中的①~⑧种元素,填写下列空白:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 零 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)上述元素中,化学性质最不活泼的是 (填元素符号)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 (填元素符号)。
(3)元素②的气态氢化物分子属于 (填电解质或非电解质);元素⑦与④形成化合物的电子式是 。
(4)元素⑤的最高价氧化物与氢氧化钠溶液反应的离子方程式为:
。
(5)元素④的某氧化物可作供氧剂,该氧化物中所含的化学键类型有 ,写出其与二氧化碳反应的化学方程式 。
【题目】下列对事实的解释不正确的是
选项 | 事实 | 解释 |
A | 用铝罐槽车储运浓硫酸 | 常温下,铝与浓硫酸不反应 |
B | 在蔗糖中加入浓硫酸后出现发黑 | 浓硫酸具有脱水性 |
C | 浓硝酸在光照下颜色变黄 | 浓HNO3不稳定,生成的有色产物NO2能溶于浓硝酸 |
D | SO2能使溴水褪色 | SO2具有还原性 |