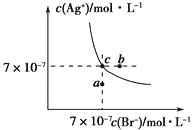
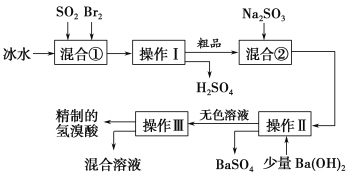
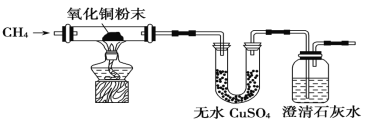
题目内容
【题目】下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。
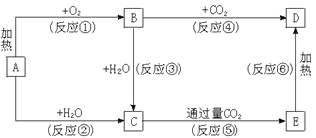
请填写下列空白:
(1)C的电子式______________,B的电子式______________,D的化学式_______________。
(2)以上反应中属于氧化还原反应的有____________________(填写编号)。
(3)写出B→D的化学方程式___________________。
【答案】(1)![]() ;
;![]() ;Na2CO3
;Na2CO3
(2)①②③④ (3)2Na2O2+2CO2=2Na2CO3+O2↑
【解析】
试题分析:它们的焰色反应都是黄色,且A为单质,则A为Na,反应①是加热,因此B为Na2O2,D为Na2CO3,C为NaOH,E:NaHCO3;
(1)根据以上分析可知C是氢氧化钠,含有离子键和共价键的离子化合物,电子式为![]() ;B是过氧化钠,含有离子键和共价键的离子化合物,电子式为
;B是过氧化钠,含有离子键和共价键的离子化合物,电子式为![]() ;碳酸钠的化学式为Na2CO3;
;碳酸钠的化学式为Na2CO3;
(2)判断是否是氧化还原反应,看是否有化合价的升降,有化合价的改变则为氧化还原反应,属于氧化还原反应的①②③④,不属于氧化还原反应的是⑤⑥;
(3)反应④是过氧化钠和CO2反应,方程式为2Na2O2+2CO2=2Na2CO3+O2↑。

【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用元素符号或化学用语回答下列问题:
族 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)下列事实能证明②的非金属性比⑦强的是 。
A.Na2CO3+SiO2![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
B.SiO2+2C![]() Si+2CO↑
Si+2CO↑
C.Na2SiO3+CO2+2H2O = H2SiO3↓+Na2CO3
D.CH4比SiH4稳定
(2)①、④、⑤三种元素组成化合物所含化学键类型有_________________。
(3)④、⑤、⑥所形成的简单离子半径由大到小的顺序:______。(用元素符号表示)
(4)①、②、⑧三种元素按原子个数之比为11︰5︰1组成的有机化合物中含有两个-CH3的同分异构体有 种。
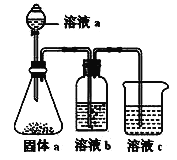
(5)某同学设计实验证明②、③、⑦的非金属性强弱关系。
①溶液a和b分别为_______________,_______________。
②溶液c中的离子方程式为______________________。