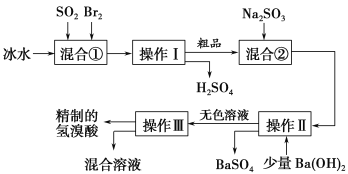
题目内容
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛,请回答下列问题:

(1)相同条件下,pH相同的NH4Al(SO4)2中c(NH4+)_________(填“=”、“>” 或“<”)NH4HSO4中c(NH4+)。
(2)如图1是0.1 molL﹣1电解质溶液的pH随温度变化的图象。
①其中符合0.1 molL﹣1 NH4Al(SO4)2的pH随温度变化的曲线是_______(填写字母);
②室温时,0.1 molL﹣1 NH4Al(SO4)2中2c(SO42-)﹣c(NH4+)﹣3c(Al3+)=________ molL﹣1(填数值)
(3)室温时,向100 mL 0.1molL﹣1 NH4HSO4溶液中滴加0.1molL﹣1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。
试分析图中a、b、c、d四个点,水的电离程度最大的是_____;在c点,溶液中各离子浓度由大到小的排列顺序是_________________。
【答案】(1)>;
(2)①Ⅰ;②10-3(或10-3-10-11);
(3)a,c(Na+)> c(SO42-) > c(NH4+) > c(OH-)> c(H+)。
【解析】
试题分析:(1)NH4HSO4=NH4++H++SO42-,溶液显强酸性,NH4Al(SO4)2利用NH4+和Al3+水解,产生弱酸性,因为pH相同,因此NH4Al(SO4)2的浓度大于NH4HSO4,即前者大于后者;
(2)①NH4Al(SO4)2的水溶液显酸性,因此III、IV错误,NH4+H2O![]() NH3·H2O+H+,Al3++3H2O
NH3·H2O+H+,Al3++3H2O![]() Al(OH)3+H+,水解是吸热反应,升高温度,促进水解,c(H+)增大,pH减小,因此I正确;②根据电中性,3c(Al3+) + c(NH4+) + c(H+) = 2c(SO42-) + c(OH-) ,2c(SO42-) - c(NH4+) - 3c(Al3+) = c(H+) - c(OH-) = 10-3 - 10-11;
Al(OH)3+H+,水解是吸热反应,升高温度,促进水解,c(H+)增大,pH减小,因此I正确;②根据电中性,3c(Al3+) + c(NH4+) + c(H+) = 2c(SO42-) + c(OH-) ,2c(SO42-) - c(NH4+) - 3c(Al3+) = c(H+) - c(OH-) = 10-3 - 10-11;
(3)水电离程度最大时,两者恰好完全反应,即a点水电离程度最大,c点时溶液溶质为NH3·H2O(50×10-3×0.1)、(NH4)2SO4(25×10-3×0.1)、Na2SO4(75×10-3×0.1),Na+和SO42-属于强碱根、强酸根,以及数据推出:c(Na+)>c(SO42-)>c(NH4+),c点NH3·H2O电离程度大于NH4+的水解,溶液显碱性,因此c(OH-)>c(H+),即c(Na+)> c(SO42-) > c(NH4+) > c(OH-)> c(H+)。

【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答:
(1)下图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。

(2)在一定体积的密闭容器中,进行如下化学反应: N2(g)+3H2(g)![]() 2NH3(g)△H <0,
2NH3(g)△H <0,
其化学平衡常数K与温度t的关系如下表:
t/K | 298 | 398 | 498 | … |
K/(mol·L-1) | 4.1×106 | K1 | K2 | … |
完成下列问题:
①比较K1、K2的大小:K1 K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是 (填序号)。
A.2v(H2)(正)=3v(NH3)(逆)
B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式 。
②盐酸肼水溶液中离子浓度的排列顺序正确的是 (填序号)。
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5·H2O]+)> c(H+)>c(OH-)
C.2 c(N2H62+)+ c([N2H5·H2O]+)+ c(H+)= c(Cl-)+ c(OH-)
D.c(N2H62+)> c(Cl-)>c(H+)>c(OH-)
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用元素符号或化学用语回答下列问题:
族 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)下列事实能证明②的非金属性比⑦强的是 。
A.Na2CO3+SiO2![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
B.SiO2+2C![]() Si+2CO↑
Si+2CO↑
C.Na2SiO3+CO2+2H2O = H2SiO3↓+Na2CO3
D.CH4比SiH4稳定
(2)①、④、⑤三种元素组成化合物所含化学键类型有_________________。
(3)④、⑤、⑥所形成的简单离子半径由大到小的顺序:______。(用元素符号表示)
(4)①、②、⑧三种元素按原子个数之比为11︰5︰1组成的有机化合物中含有两个-CH3的同分异构体有 种。
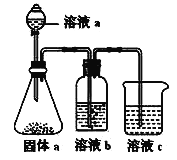
(5)某同学设计实验证明②、③、⑦的非金属性强弱关系。
①溶液a和b分别为_______________,_______________。
②溶液c中的离子方程式为______________________。
【题目】NaCl和NaClO在酸性条件下可发生反应:ClO-+ Cl-+2H+![]() Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况。
Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况。
(1)此消毒液中NaClO可吸收空气中的CO2生成NaHCO3和HClO而变质。写出化学反应方程式: 。
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过以下装置检验气体的成分,从而判断该消毒液是否变质。
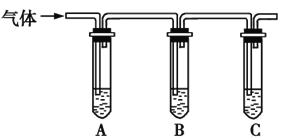
限选试剂:98%浓硫酸、1%品红溶液、1.0 mol·L-1KI-淀粉溶液、1.0 mol·L-1NaOH溶液、澄清石灰水、饱和NaCl溶液。
请完成下列实验方案。
所加试剂 | 预期现象和结论 |
向试管A中加足量①; | 若A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊,则消毒液部分变质; |
(3)用滴定法测定消毒液中NaClO的浓度。实验步骤如下:
①量取 25.00 mL消毒液放入锥形瓶中,加入过量的a mol·L-1Na2SO3溶液b mL。
②滴定分析。将c mol·L-1的酸性KMnO4溶液装入 (填“酸式”或“碱式”)滴定管中滴定,使KMnO4和剩余的Na2SO3发生反应。当溶液由无色变成浅红色,且半分钟内红色保持不褪去时,停止滴定,记录数据。重复滴定实验3次,测得平均消耗酸性KMnO4溶液V mL;滴定过程中涉及的反应有:NaClO+Na2SO3![]() NaCl+Na2SO4 ;2KMnO4+5Na2SO3+3H2SO4
NaCl+Na2SO4 ;2KMnO4+5Na2SO3+3H2SO4![]() K2SO4+2MnSO4+5Na2SO4+3H2O。
K2SO4+2MnSO4+5Na2SO4+3H2O。
③计算。消毒液中NaClO的浓度为 mol·L-1(用含a、b、c、V的代数式表示)。
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。
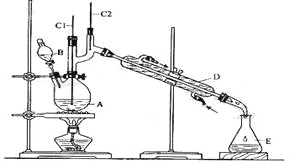
发生的反应如下:
CH3CH2CH2CH2OH![]() CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90—95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75—77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,并说明理由 。
(2)加入沸石的作用是 。若加热后发现未加沸石,应采取的正确方法 是 。
(3)上述装置图中,B的名称是 ,D仪器的名称是 。
(4)B仪器使用前必须进行的操作是 。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分液时,正丁醛在 层(填“上”或“下”)
(6)反应温度应保持在90—95℃,其原因是 ,为更好的控制温度,可以采取的改进措施是 。
(7)本实验中,正丁醛的产率为 %。