题目内容
【题目】原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同:D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为25。
(1)F基态原子的核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是(用元素符号回答) 。
(3)元素B的简单气态氢化物的沸点远高于元素A的简单气态氢化物的沸点,其主要原因是 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。

【答案】(1)1s22s22p63s23p63d54s2 (2)C、O、N 或C< O< N
(3)B的氢化物NH3分子之间存在氢键 (4)[N=C=O]-(5)sp (6)NaNO2
【解析】
试题分析:原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等,A为C元素,A的基态原子,2p能级上的未成对电子数为2,C的基态原子2p能级上的未成对电子数与A原子的相同,那么C是O元素,B是N元素,D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为25,可以推出E为S元素,D为Na元素,F为Mn元素。(1)F基态原子的核外电子排布式为[Ar] 3d54s2 或1s22s22p63s23p63d54s2,答案为:[Ar] 3d54s2 或1s22s22p63s23p63d54s2 ;(2)C、N、O三种元素中第一店里能由小到大的顺序为:C、O、N ,答案为:C、O、N 或C< O< N;(3)元素B的简单气态氢化物的沸点远高于元素A的简单气态氢化物的沸点,是由于NH3分子之间可以形成氢键,而CH4分子间没有氢键,答案为:B的氢化物NH3分子之间存在氢键;(4)已知CO2为直线型分子,C原子和每一个氧原子之间以双键相连接,由A、B、C形成的离子CAB-与AC2互为等电子体,所以NCO-也为直线型,C与N和C与O原子之间以双键相连,答案为:[N=C=O]-;(5)元素A与E所形成的常见化合物为CS2,C与S原子间为双键,所以C的价层电子对数为2,C原子采取sp杂化,答案为:sp;(6)Na+在棱边上,用均摊法可以算出Na+的个数为:8×1/4=2,NO2-可以当成一个整体看,NO2-主要位于顶点和体心,用均摊法计算得NO2-的个数为:1+8×1/8=2,所以化学式为:NaNO2,答案为:NaNO2。

【题目】下表是元素周期表的一部分, 针对表中的①~⑧种元素,填写下列空白:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 零 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)上述元素中,化学性质最不活泼的是 (填元素符号)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 (填元素符号)。
(3)元素②的气态氢化物分子属于 (填电解质或非电解质);元素⑦与④形成化合物的电子式是 。
(4)元素⑤的最高价氧化物与氢氧化钠溶液反应的离子方程式为:
。
(5)元素④的某氧化物可作供氧剂,该氧化物中所含的化学键类型有 ,写出其与二氧化碳反应的化学方程式 。
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答:
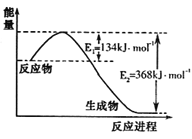
(1)下图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。
(2)在一定体积的密闭容器中,进行如下化学反应: N2(g)+3H2(g)![]() 2NH3(g)△H <0,
2NH3(g)△H <0,
其化学平衡常数K与温度t的关系如下表:
t/K | 298 | 398 | 498 | … |
K/(mol·L-1) | 4.1×106 | K1 | K2 | … |
完成下列问题:
①比较K1、K2的大小:K1 K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是 (填序号)。
A.2v(H2)(正)=3v(NH3)(逆)
B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式 。
②盐酸肼水溶液中离子浓度的排列顺序正确的是 (填序号)。
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5·H2O]+)> c(H+)>c(OH-)
C.2 c(N2H62+)+ c([N2H5·H2O]+)+ c(H+)= c(Cl-)+ c(OH-)
D.c(N2H62+)> c(Cl-)>c(H+)>c(OH-)