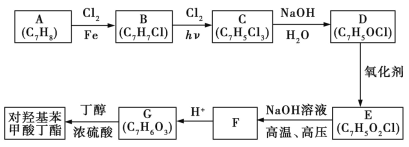
题目内容
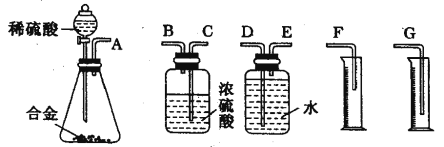
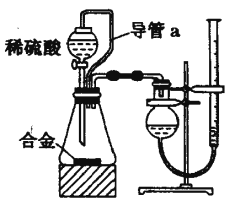
【题目】某同学用下列装置制备并检验Cl2的性质。
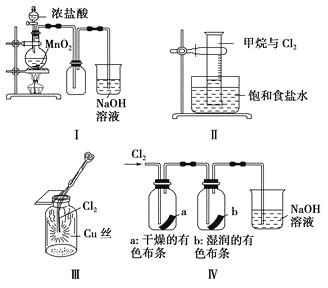
下列说法正确的是
A. Ⅰ图中:如果MnO2过量,浓盐酸就可全部被消耗
B. Ⅱ图中:量筒中发生了加成反应
C. Ⅲ图中:生成蓝色的烟
D. Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
【答案】D
【解析】试题分析:A.浓盐酸与二氧化锰的反应过程中浓度逐渐降低,稀盐酸与二氧化锰不反应,所以Ⅰ图中:如果MnO2过量,浓盐酸也不可能全部被消耗,A错误;B.Ⅱ图中:量筒中发生了甲烷和氯气的取代反应,B错误; C.Ⅲ图中铜和氯气反应生成氯化铜,产生棕黄色烟,C错误;D.氯气与水反应生成的次氯酸具有漂白性,因此Ⅳ图中湿润的有色布条能褪色。氯气与氢氧化钠反应生成次氯酸钠、氯化钠和水,加入硫酸后次氯酸钠氧化氯离子生成氯气,D正确,答案选D。

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案
相关题目
【题目】下列对事实的解释不正确的是
选项 | 事实 | 解释 |
A | 用铝罐槽车储运浓硫酸 | 常温下,铝与浓硫酸不反应 |
B | 在蔗糖中加入浓硫酸后出现发黑 | 浓硫酸具有脱水性 |
C | 浓硝酸在光照下颜色变黄 | 浓HNO3不稳定,生成的有色产物NO2能溶于浓硝酸 |
D | SO2能使溴水褪色 | SO2具有还原性 |