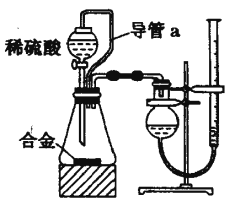
题目内容
【题目】【化学——选修5:有机化学基础】
有机物G(分子式为C13H18O2)是一种香料,如图是该香料的一种合成路线。
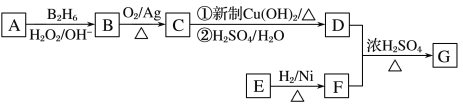
已知:
①E能发生银镜反应,在一定条件下,1 mol E能与2 mol H2反应生成F;
②R—CH===CH2  R—CH2CH2OH;
R—CH2CH2OH;
③有机物D的摩尔质量为88 g·mol-1,其核磁共振氢谱有3组峰;
④有机物F是苯甲醇的同系物,苯环上只有一个无支链的侧链。
回答下列问题:
(1)用系统命名法命名有机物B________________。
(2)E的结构简式为__________________________。
(3)C与新制Cu(OH)2反应的化学方程式为________________________________________。
(4)已知有机物甲符合下列条件:①为芳香族化合物;②与F互为同分异构体;③能被催化氧化成醛。符合上述条件的有机物甲有________种,写出一种满足苯环上有3个侧链,且核磁共振氢谱有5组峰,峰面积比为6:2:2:1:1的有机物的结构简式____________________。
(5)以丙烯等为原料合成D的路线如下:
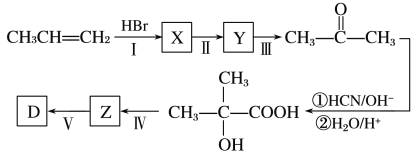
X的结构简式为_______,步骤Ⅱ的反应条件为___________,步骤Ⅳ的反应类型为______。
【答案】(1)2-甲基-1-丙醇
(2)C6H5CH=CHCHO
(3)(CH3)2CHCHO+2Cu(OH)2+NaOH![]() (CH3)2CHCOONa+Cu2O↓+3H2O
(CH3)2CHCOONa+Cu2O↓+3H2O
(4)13 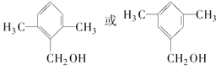
(5)CH3CHBrCH3 NaOH的水溶液,加热 消去反应
【解析】本题主要考查的是有机化合物的推断。(1)B为(CH3)2CHCHOH,其用系统命名法命名为2-甲基-1-丙醇,故答案为:2-甲基-1-丙醇;(2)F为C6H5CH2CH2CH2OH,E能够发生银镜反应,1 molE与2 molH2反应生成F,则E为C6H5CH=CHCHO,故答案为:C6H5CH=CHCHO;(3)C为(CH3)2CHCHO,其与新制氢氧化铜的化学方程式为(CH3)2CHCHO+2Cu(OH)2+NaOH![]() (CH3)2CHCOONa+Cu2O↓+3H2O,故答案为:(CH3)2CHCHO+2Cu(OH)2+NaOH
(CH3)2CHCOONa+Cu2O↓+3H2O,故答案为:(CH3)2CHCHO+2Cu(OH)2+NaOH![]() (CH3)2CHCOONa+Cu2O↓+3H2O;(4)F为C6H5CH2CH2CH2OH,符合①为芳香族化合物;②与F互为同分异构体;③能被催化氧化成醛的化合物有:若苯环上只有一个取代基,取代基为CH(CH3)CH2OH,只有1种;若苯环上由2个取代基,可能是甲基和CH2CH2OH,邻间对3种,也可以是-CH2CH3和- CH2OH,邻间对3种;若苯环上由3个取代基,只能是两个-CH3和- CH2OH,采用定一议二判断,有六种,所以共13种,其中满足苯环上由3个侧链,且核磁共振氢谱由5组峰,峰面积比为6:2:2:1:1的有机物的结构简式:
(CH3)2CHCOONa+Cu2O↓+3H2O;(4)F为C6H5CH2CH2CH2OH,符合①为芳香族化合物;②与F互为同分异构体;③能被催化氧化成醛的化合物有:若苯环上只有一个取代基,取代基为CH(CH3)CH2OH,只有1种;若苯环上由2个取代基,可能是甲基和CH2CH2OH,邻间对3种,也可以是-CH2CH3和- CH2OH,邻间对3种;若苯环上由3个取代基,只能是两个-CH3和- CH2OH,采用定一议二判断,有六种,所以共13种,其中满足苯环上由3个侧链,且核磁共振氢谱由5组峰,峰面积比为6:2:2:1:1的有机物的结构简式:  ,故答案为:13
,故答案为:13 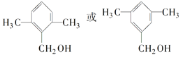 ;(5)D的简式为(CH3)2CHCOOH,以丙烯等为原料合成D的路线可知,反应I为加成反应,X为CH3CHBrCH3,其在NaOH的水溶液中加热生成CH3CHOHCH3,反应IV为消去反应,故答案为:CH3CHBrCH3 NaOH的水溶液,加热;消去反应。
;(5)D的简式为(CH3)2CHCOOH,以丙烯等为原料合成D的路线可知,反应I为加成反应,X为CH3CHBrCH3,其在NaOH的水溶液中加热生成CH3CHOHCH3,反应IV为消去反应,故答案为:CH3CHBrCH3 NaOH的水溶液,加热;消去反应。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】NaCl和NaClO在酸性条件下可发生反应:ClO-+ Cl-+2H+![]() Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况。
Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况。
(1)此消毒液中NaClO可吸收空气中的CO2生成NaHCO3和HClO而变质。写出化学反应方程式: 。
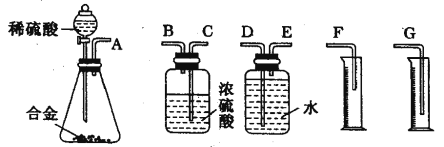
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过以下装置检验气体的成分,从而判断该消毒液是否变质。
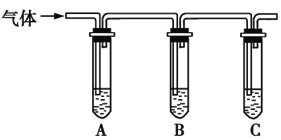
限选试剂:98%浓硫酸、1%品红溶液、1.0 mol·L-1KI-淀粉溶液、1.0 mol·L-1NaOH溶液、澄清石灰水、饱和NaCl溶液。
请完成下列实验方案。
所加试剂 | 预期现象和结论 |
向试管A中加足量①; | 若A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊,则消毒液部分变质; |
(3)用滴定法测定消毒液中NaClO的浓度。实验步骤如下:
①量取 25.00 mL消毒液放入锥形瓶中,加入过量的a mol·L-1Na2SO3溶液b mL。
②滴定分析。将c mol·L-1的酸性KMnO4溶液装入 (填“酸式”或“碱式”)滴定管中滴定,使KMnO4和剩余的Na2SO3发生反应。当溶液由无色变成浅红色,且半分钟内红色保持不褪去时,停止滴定,记录数据。重复滴定实验3次,测得平均消耗酸性KMnO4溶液V mL;滴定过程中涉及的反应有:NaClO+Na2SO3![]() NaCl+Na2SO4 ;2KMnO4+5Na2SO3+3H2SO4
NaCl+Na2SO4 ;2KMnO4+5Na2SO3+3H2SO4![]() K2SO4+2MnSO4+5Na2SO4+3H2O。
K2SO4+2MnSO4+5Na2SO4+3H2O。
③计算。消毒液中NaClO的浓度为 mol·L-1(用含a、b、c、V的代数式表示)。