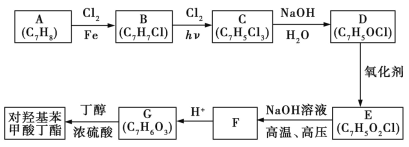
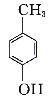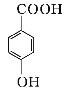题目内容
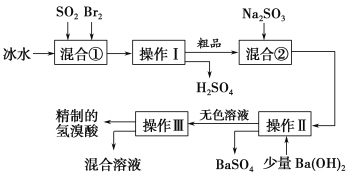
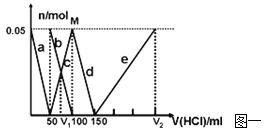
【题目】向FeCl3、Al2(SO4)3的混合溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。沉淀的生成与溶解的pH列于下表。以下推断正确的是
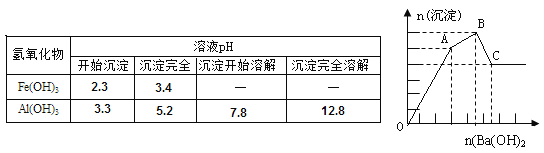
A.AB段可能发生的反应是:2SO42-+2Ba2++Al3++3OH-=2BaSO4↓+Al(OH)3↓
B.C点的沉淀为Fe(OH)3
C.OA段可能发生的反应是:3Ba2++6OH-+3SO42-+Fe3++Al3+=3BaSO4↓+Fe(OH)3↓+Al(OH)3↓
D.据图计算原溶液中c(Cl-)>c(SO42-)
【答案】C
【解析】
试题分析:向含FeCl3、Al2(SO4)3的混合溶液与Ba(OH)2溶液反应的实质是Fe3+,Al3+与OH-、Ba2+与SO42-之间的离子反应为:Ba2++SO42-═BaSO4↓、Fe3++3OH-=Fe(OH)3↓、Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O。假设1mol Al2(SO4)3中SO42-完全被沉淀所需Ba(OH)2的物质的量为3mol,提供6molOH-,图表分析铁离子先沉淀,由图象分析,OA段为加入3molBa(OH)2,发生反应Ba2++SO42-═BaSO4↓,得到3molBaSO4沉淀,C点为氢氧化铝溶解后的沉淀物质的量为氢氧化铁和硫酸钡沉淀共4mol,所以氢氧化铁沉淀为1mol,氢氧化铝沉淀为2mol;分析判断OA段沉淀3mol钡离了,1mol铁离子和1mol铝离子;AB段为沉淀1mol铝离子;BC段为溶解氢氧化铝消耗氢氧化钡1mol,A.AB段可能发生的反应是:Al3++3OH-═Al(OH)3↓,A错误;B.根据分析可知,C点沉淀为BaSO4和Fe(OH)3,B错误;C.OA段可能发生的反应有沉淀钡离子,铁离子,铝离子,反应为,3Ba2++6OH-+3SO42-+Fe3++Al3+=3BaSO4↓+Fe(OH)3↓+Al(OH)3↓,也可能发生3Ba2++6OH-+3SO42-+2Fe3+=3BaSO4↓+2Fe(OH)3↓,C正确;D.图象分析FeCl3、Al2(SO4)3的混和溶液中含FeCl3 1mol,含Al2(SO4)31mol,则c(Cl-)=c(SO42-),D错误,答案选C。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
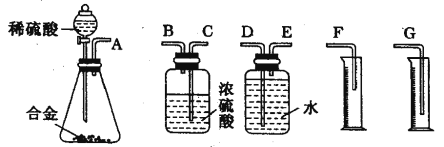
百强名校期末冲刺100分系列答案【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。

发生的反应如下:
CH3CH2CH2CH2OH![]() CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90—95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75—77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,并说明理由 。
(2)加入沸石的作用是 。若加热后发现未加沸石,应采取的正确方法 是 。
(3)上述装置图中,B的名称是 ,D仪器的名称是 。
(4)B仪器使用前必须进行的操作是 。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分液时,正丁醛在 层(填“上”或“下”)
(6)反应温度应保持在90—95℃,其原因是 ,为更好的控制温度,可以采取的改进措施是 。
(7)本实验中,正丁醛的产率为 %。