题目内容
【题目】食盐中含有一定量的镁、铁等物质,加碘盐中碘的损失主要由于杂质、水份、空气中的氧气以及光照,受热而引起的. 已知:氧化性:IO3﹣>Fe3+>I2还原性:S2O32﹣>I﹣
反应式:3I2+6OH﹣═5I﹣+IO3﹣+3H2O,KI+I2KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+).用适量蒸馏水溶解,并加稀硫酸酸化,将所得溶液分3份:第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显示淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入足量的KIO3固体后,滴加淀粉试剂,溶液不变色. ①该红色物质是(用化学式表示);CCl4中显示紫红色的物质是(用电子式表示).
②第二份试液中加入足量KI固体后,反应的离子方程式为;
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失.写出潮湿环境中KI与氧气反应的化学方程式: . 将I2溶于KI溶液,在低温条件下,可制得KI3H2O.该物质作为食盐加碘剂是否合适?
(填“是”或“否”),并说明理由: .
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是 .
A.Na2S2O3
B.AlCl3
C.Na2CO3
D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂.请设计实验方案,检验该加碘盐中的Fe2+: .
【答案】
(1)Fe(SCN)3; ![]() ; IO3﹣+5I﹣+6H+═3I2+3H2O或2Fe3++2I﹣═I2+2Fe2+
; IO3﹣+5I﹣+6H+═3I2+3H2O或2Fe3++2I﹣═I2+2Fe2+
(2)4KI+O2+2H2O═2I2+4KOH;否; KI3在受热或潮湿条件下产生I2和KI,KI易被氧化生成碘,碘易升华
(3)AC
(4)取足量该碘盐溶于蒸馏水中,用盐酸酸化,滴加适量氧化剂(如氯水、过氧化氢等),再滴加KSCN溶液,若溶液变血红色,则该加碘盐中存在Fe2+
【解析】解:(1)①根据实验现象判断第一份溶液为红色,说明溶液中含有铁离子与KSCN反应生成Fe(SCN)3,所以红色物质是Fe(SCN)3,第二份试液中加足量KI固体,溶液显示淡黄色,用CCl4萃取,下层溶液显紫红色,说明紫色物质是碘单质,I2的电子式为 ![]() ,
,
故答案为:Fe(SCN)3; ![]() ;②食盐中的碘酸根离子与碘离子在酸性条件下发生氧化还原反应生成单质碘,或者是铁离子与碘离子发生氧化还原反应生成了单质碘,离子方程式为IO3﹣+5I﹣+6H+=3I2+3H2O或2Fe3++2 I﹣=I2+2Fe2+,
;②食盐中的碘酸根离子与碘离子在酸性条件下发生氧化还原反应生成单质碘,或者是铁离子与碘离子发生氧化还原反应生成了单质碘,离子方程式为IO3﹣+5I﹣+6H+=3I2+3H2O或2Fe3++2 I﹣=I2+2Fe2+,
故答案为:IO3﹣+5I﹣+6H+═3I2+3H2O或2Fe3++2I﹣═I2+2Fe2+;(2)潮湿环境中KI与氧气发生氧化还原反应生成单质碘,碘易升华,引起碘的损失,反应的化学方程式为4KI+O2+2H2O=2I2+4KOH;用KI3H2O作加碘试剂不合适,因为KI3H2O是在低温下制取的,受热分解产生KI和碘单质,且KI易被氧化生成碘,碘易升华,
故答案为:4KI+O2+2H2O═2I2+4KOH;否;KI3在受热或潮湿条件下产生I2和KI,KI易被氧化生成碘,碘易升华;(3)提高加碘盐的稳定性主要是防止I﹣被氧化,所以应选择还原性的试剂.A中的S元素的化合价是+2价,先于I﹣被氧化,正确;B不能作还原剂,错误;C中的碳酸根离子与盐中的铁离子反应生成沉淀,防止铁离子氧化碘离子,正确;D、亚硝酸钠是有毒物质,错误,
故答案为:AC;(4)已经说明无铁离子,所以直接加入氧化性物质,再加入KSCN溶液若溶液变红则证明原物质中含有亚铁离子,具体操作如下:取足量该碘盐溶于蒸馏水中,用盐酸酸化,滴加适量氧化剂(如氯水、过氧化氢等),再滴加KSCN溶液,若溶液变血红色,则该加碘盐中存在Fe2+,
故答案为:取足量该碘盐溶于蒸馏水中,用盐酸酸化,滴加适量氧化剂(如氯水、过氧化氢等),再滴加KSCN溶液,若溶液变血红色,则该加碘盐中存在Fe2+.
(1)①根据实验现象判断第一份溶液为红色,说明溶液中含有铁离子与KSCN反应生成Fe(SCN)3,第二份试液中加足量KI固体,溶液显示淡黄色,用CCl4萃取,下层溶液显紫红色,说明紫色物质是碘单质;②食盐中的碘酸根离子与碘离子在酸性条件下发生氧化还原反应生成单质碘,或者是铁离子与碘离子发生氧化还原反应生成了单质碘;(2)潮湿环境中KI与氧气发生氧化还原反应生成单质碘,碘易升华,引起碘的损失;用KI3H2O作加碘试剂不合适,因为KI3H2O是在低温下制取的,受热分解产生KI和碘单质,且KI易被氧化生成碘;(3)提高加碘盐的稳定性主要是防止I﹣被氧化,所以应选择还原性的试剂;(4)已经说明无铁离子,所以直接加入氧化性物质,再加入KSCN溶液若溶液变红则证明原物质中含有亚铁离子.

【题目】乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某校化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.
(1)【观察与思考】 乙醇分子的核磁共振氢谱有个吸收峰.
(2)【活动与探究】 (i)甲同学向小烧杯中加入无水乙醇,再放入一小块金属钠(约绿豆粒大),观察实验现象.请在下表中将观察到的实验现象及结论补充完全(有多少现象等就填多少,不必填满).
实验现象 | 结 论 | |
① | 钠沉在乙醇下面 | 钠的密度大于乙醇 |
② |
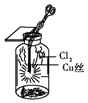
(ii)乙同学向试管中加入3~4mL无水乙醇,浸入50℃左右的热水中,再将铜丝烧至红热,迅速插入乙醇中,反复多次.则此时乙醇发生反应的化学方程式为(生成乙醛) . 欲验证此实验的有机产物,可以将产物加入盛有的试管中并在酒精灯火焰上直接加热,观察现象即可,此反应的化学方程式为 .
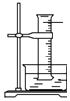
(3)【交流与讨论】 丙同学向一支试管中加入3mL 乙醇,然后边摇动试管边慢慢加入2mL浓硫酸和2mL冰醋酸,按下图所示连接好装置,请指出该装置的主要错误是 . 假如乙醇分子中的氧原子为18O原子,则发生此反应后,18O原子将出现在生成物中(填字母).
A.水 B.乙酸乙酯 C.水和乙酸乙酯.