题目内容
【题目】中科院宁波材料所研发金属空气电池获得重大突破.该电池的工作原理如图所示:下列有关说法正确的是( )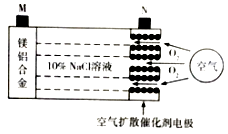
A.电池工作时,负极附近溶液的pH升高
B.电池工作时,电流由M极经外电路流向N极
C.电路中转移2mol电子,理论上约消耗标准状况下空气56L
D.电池总反应为4Al+3O2=2Al2O3、2Mg+O2=2MgO
【答案】C
【解析】A、根据原电池的工作原理可以看出:活泼金属镁和铝的合金是负极,该电极上发生失电子的氧化反应,即Mg﹣2e﹣=Mg2+,正极上是氧气得电子的还原反应,产生氢氧根离子,氢氧根离子和镁离子之间反应会得到氢氧化镁,负极附近溶液的pH降低,A不符合题意;
B、电池工作时,电流从正极流向负极,即由N极经外电路流向M极,B不符合题意;
C、电路中转移2mol电子,根据正极上发生反应:O2+4H++4e﹣=2H2O,消耗氧气的物质的量是0.5mol,标况下的体积是11.2L,理论上约消耗标准状况下空气56L,C符合题意;
D、电池总反应为2Mg+O2+2H2O=2Mg(OH)2↓,D不符合题意;
所以答案是:C

练习册系列答案
相关题目