题目内容
15.下列实验能达到预期目的是( )| A. |  用于判断SO2能否与钡盐反应 | B. |  用于判断硼酸、碳酸的酸性强弱 | ||
| C. | 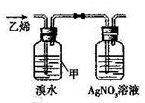 用于判断甲中发生的是加成反应 | D. | 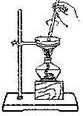 用于AlCl3的蒸发结晶 |
分析 A.二氧化硫与氯化钡不反应;
B.发生强酸制取弱酸的反应;
C.溴易挥发;
D.水解生成的盐酸易挥发.
解答 解:A.只能得出SO2与BaCl2溶液能否反应的结论,但无法得到它能否与其它钡盐反应的结论,故A错误;
B.若生成气体可知碳酸酸性弱,若不生成气体可知硼酸酸性弱,由最高价氧化物水化物的酸性可比较非金属性,故B正确;
C.由于溴具有挥发性,故乙中会出现浅黄色沉淀,不能说明反应类型,故C错误;
D.直接蒸发AlCl3溶液时,Al3+水解到底导致最终得不到AlCl3晶体,应在HCl气流中蒸发,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的性质、酸性和非金属性比较、有机物的性质及离子检验、盐类水解及应用等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
4.下列各元素,按原子半径依次增大,元素最高正价逐渐降低的顺序排列的是( )
| A. | F、Cl、Br | B. | Al、Mg、Na | C. | N、S、Cl | D. | F、O、N |
6.用下列装置进行相应的实验,能实现预期目的是( )
| A | B | C | D | |
| 装置 |  |  H2(g)+I2(g)?2HI(g) | 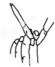 |  |
| 目的 | 检验碳与浓硫酸反应的氧化产物 | 验证压强对化学平衡的影响 | 检查碱式滴定管是否漏液 | FeSO4溶液的蒸发结晶 |
| A. | A | B. | B | C. | C | D. | D |
3.化学与人类社会的生产、生活有着密切联系.下列叙述中正确的是( )
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 用活性炭为蔗糖脱色和用臭氧漂白纸浆,原理相似 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 |
10.25℃时,K甲(BaSO4)=1×10-10,K甲(BaCO3)=2.6×10-8,该温度下,下列说法不正确的是( )
| A. | 相同浓度的Na2SO4和Na2CO3的混合溶液中添加BaCl2溶液,BaSO4先析出 | |
| B. | 向BaCO3的悬浊液中加入少量的新制氯水,r(Ba2+)增大 | |
| C. | BaSO4和BaCO3共存的悬浊液中,c(SO42-)/c(CO32-)=1/26 | |
| D. | 向BaSO4的悬浊液中加入Na2CO3的浓溶液,BaSO4不可能转化为BaCO3 |
20.酯化反应是有机化学中的一类重要反应,下列对酯化反应理解不正确的是( )
| A. | 酯化反应的产物只有酯 | |
| B. | 酯化反应一般需要用NaOH溶液来吸收生成的酯 | |
| C. | 酯化反应是有限度的 | |
| D. | 浓硫酸可做酯化反应的催化剂 |
7.下列说法或表达正确的是( )
| A. | 乙醇、糖类和蛋白质都是人体必需的营养物质 | |
| B. | 石油是混合物,其分馏产品汽油也是混合物 | |
| C. | “海水淡化”可以解决“淡水供应危机”,加入明矾可以使海水淡化 | |
| D. | 陶瓷、水晶、水泥、玻璃都属于硅酸盐 |
5.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1NH4HCO3溶液:K+、Na+、SO42-、OH- | |
| B. | 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | |
| C. | 0.1 mol•L-1CH3COONa溶液:Mg2+、H+、Cl-、SO42- | |
| D. | Kw/c(H+)=0.1 mol•L-1的溶液:Na+、K+、SiO32-、NO3- |