题目内容
20.短周期元素X、Z、W、Q在元素周期表中的位置如图所示,其中X元素原子最外层电子数是最内层电子数的3倍,则下列说法正确的是( )| X | Y | ||
| Z | W | Q |
| A. | X、W能与钠形成摩尔质量相同的化合物,且阴阳离子数比为1:2 | |
| B. | 含X和Z元素的常见化合物为分子晶体 | |
| C. | 氧化物对应的水化物酸性:W<Q | |
| D. | 原子半径大小关系:Q>W>Z>Y |
分析 由短周期元素X、Z、W、Q在元素周期表中的位置,可知X、Y处于第二周期,Z、W、Q处于第三周期,其中X元素原子最外层电子数是最内层电子数的3倍,最外层电子数为6,故X为O元素,可推知Y为F元素、Z为Si、W为S、Q为Cl,据此解答.
解答 解:由短周期元素X、Z、W、Q在元素周期表中的位置,可知X、Y处于第二周期,Z、W、Q处于第三周期,其中X元素原子最外层电子数是最内层电子数的3倍,最外层电子数为6,故X为O元素,可推知Y为F元素、Z为Si、W为S、Q为Cl,
A.O、S能与钠形成摩尔质量相同的化合物为Na2O2、Na2S,二者阴、阳离子数比均为1:2,故A正确;
B.含X和Z元素的常见化合物为SiO2,属于原子晶体,故B错误;
C.非金属性W(S)<Q(Cl),故最高价氧化物对应的水化物酸性:W<Q,不是最高价的含氧酸则不一定,如硫酸为强酸,而次氯酸为弱酸,故C错误;
D.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Z(Si)>W(S)>Q(Cl)>Y(F),故D错误,
故选A.
点评 本题考查位置结构性质关系应用,关键是推断元素,注意对元素周期律的理解掌握,难度不大.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
10.25℃时,K甲(BaSO4)=1×10-10,K甲(BaCO3)=2.6×10-8,该温度下,下列说法不正确的是( )
| A. | 相同浓度的Na2SO4和Na2CO3的混合溶液中添加BaCl2溶液,BaSO4先析出 | |
| B. | 向BaCO3的悬浊液中加入少量的新制氯水,r(Ba2+)增大 | |
| C. | BaSO4和BaCO3共存的悬浊液中,c(SO42-)/c(CO32-)=1/26 | |
| D. | 向BaSO4的悬浊液中加入Na2CO3的浓溶液,BaSO4不可能转化为BaCO3 |
8.下列各组离子在溶液中能大量共存的是( )
| A. | K+、OH-、Na+、NO3- | B. | Al3+、AlO2-、HCO3-、Na+ | ||
| C. | Na+、Fe3+、SO42-、I- | D. | Fe3+、SCN-、Na+、CO32- |
15.下列说法正确的是( )
| A. | 乙烯使溴水或酸性高锰酸钾溶液褪色均属于加成反应 | |
| B. | 乙醇与浓硫酸混合,加热至170°C制乙烯的反应属于取代反应 | |
| C. | 用酸性重铬酸钾溶液检验酒驾,发生的反应属于乙醇的氧化反应 | |
| D. | 等质量的乙烯和乙醇完全燃烧,消耗O2的物质的量相同 |
5.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1NH4HCO3溶液:K+、Na+、SO42-、OH- | |
| B. | 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | |
| C. | 0.1 mol•L-1CH3COONa溶液:Mg2+、H+、Cl-、SO42- | |
| D. | Kw/c(H+)=0.1 mol•L-1的溶液:Na+、K+、SiO32-、NO3- |
9.已知:某温度时,KW=1.0×10-12.在该温度下,测得0.1mol•L-1Na2A溶液pH=6,则下列说法正确的是( )
| A. | H2A在水溶液中的电离方程式为:H2A=H++HA-,HA-?H++A2- | |
| B. | 常温下,NH4HA溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(A2-) | |
| C. | 相同条件下,体积相等、pH相等的盐酸与H2A溶液中和NaOH的量相等 | |
| D. | 0.0l mol•L-l的NaHA溶液pH>2 |
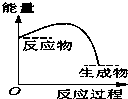
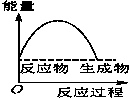
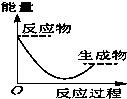
 将某固体氢氧化物M与NH4Cl置于如图所示的装置(玻璃片与烧杯底部之间有一薄层水)中混合反应后,用手拿起烧杯时,发现玻璃片与烧杯粘在一起,则该反应所对应的能量变化关系图是( )
将某固体氢氧化物M与NH4Cl置于如图所示的装置(玻璃片与烧杯底部之间有一薄层水)中混合反应后,用手拿起烧杯时,发现玻璃片与烧杯粘在一起,则该反应所对应的能量变化关系图是( )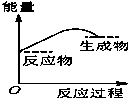

 SO42-+CaCO3.
SO42-+CaCO3.