题目内容
15.氯水的下列性质是由氯水中的什么成分决定的?(1)向氯水中加入紫色石蕊溶液,先变红后褪色:H+、HClO
(2)向氯水中加入少量Na2CO3固体产生能够使澄清石灰水变浑浊的气体:H+
(3)向氯水中滴加AgNO3产生白色沉淀不溶于硝酸的沉淀:Cl-.
(4)新制的氯水呈黄绿色:Cl2.
分析 Cl2+H2O?HCl+HClO,该反应是可逆反应,所以氯水中含有的微粒是:分子:Cl2、HClO、H2O;离子:H+、Cl-、ClO-、OH-,以此来解答.
解答 解:(1)向氯水中加入紫色石蕊溶液,含H+先变红,含HClO具有漂白性后褪色,故答案为:H+、HClO;
(2)氯水中含H+,加入少量Na2CO3固体产生能够使澄清石灰水变浑浊的气体,故答案为:H+;
(3)氯水中含Cl-,滴加AgNO3产生白色沉淀不溶于硝酸的沉淀AgCl,故答案为:Cl-;
(4)新制的氯水含Cl2,呈黄绿色,故答案为:Cl2.
点评 本题考查了氯水的成分及性质,为高频考点,把握氯水中存在的微粒是解答的关键,侧重分析与用应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1NH4HCO3溶液:K+、Na+、SO42-、OH- | |
| B. | 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | |
| C. | 0.1 mol•L-1CH3COONa溶液:Mg2+、H+、Cl-、SO42- | |
| D. | Kw/c(H+)=0.1 mol•L-1的溶液:Na+、K+、SiO32-、NO3- |
6.下列各晶体中任意一个原子都被相邻的4个原子所包围:以共价键结合成正四面体结构,并向空间伸展成网状结构的是( )
| A. | 甲烷 | B. | 石墨 | C. | 晶体硅 | D. | 水晶 |
3.电解NO制备NH4NO3,其工作原理如图所示,下列说法不正确的是( )
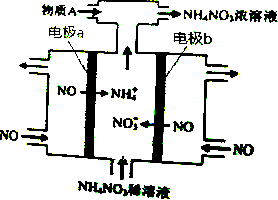

| A. | b极的电极反应为:NO-3e-+4OH-=NO${\;}_{3}^{-}$+2H2O | |
| B. | 溶液中的H+由电极b处向电极a处迁移 | |
| C. | 电解过程总反应的化学方程式为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3 | |
| D. | 为使电解产物全部转化为NH4NO3,需补充的物质A是NH3 |
5.下列判断错误的是( )
| A. | 沸点:NH3>AsH3>PH3 | B. | 熔点:Cs>Li>Na | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
 SO42-+CaCO3.
SO42-+CaCO3.
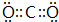 ;
; ;
;