题目内容
10.一种具有除草功效的有机物的结构简式如图所示.下列有关该化合物的说法正确的是( )
| A. | 分子中含有2个手性碳原子 | |
| B. | 能发生氧化、取代、加成反应 | |
| C. | 1 mol该化合物与足量浓溴水反应,最多消耗3 mol Br2 | |
| D. | 1 mol该化合物与足量NaOH溶液反应,最多消耗4 mol NaOH |
分析 由结构简式可知分子中含酚-OH、碳碳双键、-COOC-,结合酚、烯烃及酯的性质来解答.
解答 解:A.连4个不同基团的C为手性碳原子,只有与苯环、酯基直接相连的1个C为手性碳原子,故A错误;
B.含双键可发生加成、氧化反应,含-OH可发生氧化、取代反应,故B正确;
C.酚-OH的邻对位与溴水发生取代,碳碳双键与溴水发生加成反应,则1 mol该化合物与足量浓溴水反应,最多消耗4 mol Br2,故C错误;
D.酚-OH、-COOC-均与NaOH溶液反应,1 mol该化合物与足量NaOH溶液反应,最多消耗4 mol NaOH,故D正确;
故选BD.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重常见有机物性质及迁移应用能力的考查,题目难度不大.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
20.酯化反应是有机化学中的一类重要反应,下列对酯化反应理解不正确的是( )
| A. | 酯化反应的产物只有酯 | |
| B. | 酯化反应一般需要用NaOH溶液来吸收生成的酯 | |
| C. | 酯化反应是有限度的 | |
| D. | 浓硫酸可做酯化反应的催化剂 |
1.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 58 g乙烯和乙烷的混合气体中碳原子数目一定为4NA | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 142g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA | |
| D. | 已知3BrF3+5H2O=HBrO3+Br2+9HF+O2↑ 如果有5mol H2O参加氧化还原反应,则由水还原的BrF3分子数目为3NA |
18.a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示.
请回答:
(l)d属于d区的元素,其基态原子的价电子排布图为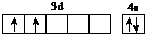 .
.
(2)b与其同周期相邻元素第一电离能由大到小的顺序为N>O>C(用元素符号表示).
(3)c的氢化物水溶液中存在的氢键有4种,任意画出一种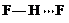 、
、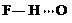 、
、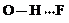 、
、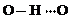 任意一种.
任意一种.
(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为SiO2>CO2(用化学式表示).若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为平面三角形;A的中心原子的轨道杂化类型为sp3杂化;与A互为等电子体的一种分子为SO3(填化学式).
(5)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的 晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为H4Cu3Au,若该晶体的相对分子质量为M,密度为ag/cm3,则晶胞的体积为$\frac{M}{a{N}_{A}}$ cm3(NA用表示阿
伏加德罗常数的值).
| a | 原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| b | 基态原子的p轨道电子数比s轨道电子数少1 |
| c | 在周期表所列元素中电负性最大 |
| d | 位于周期表中第4纵行 |
| e | 基态原子M层全充满,N层只有一个电子 |
(l)d属于d区的元素,其基态原子的价电子排布图为
 .
.(2)b与其同周期相邻元素第一电离能由大到小的顺序为N>O>C(用元素符号表示).
(3)c的氢化物水溶液中存在的氢键有4种,任意画出一种
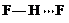 、
、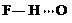 、
、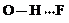 、
、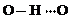 任意一种.
任意一种.(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为SiO2>CO2(用化学式表示).若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为平面三角形;A的中心原子的轨道杂化类型为sp3杂化;与A互为等电子体的一种分子为SO3(填化学式).
(5)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的 晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为H4Cu3Au,若该晶体的相对分子质量为M,密度为ag/cm3,则晶胞的体积为$\frac{M}{a{N}_{A}}$ cm3(NA用表示阿
伏加德罗常数的值).
5.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1NH4HCO3溶液:K+、Na+、SO42-、OH- | |
| B. | 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | |
| C. | 0.1 mol•L-1CH3COONa溶液:Mg2+、H+、Cl-、SO42- | |
| D. | Kw/c(H+)=0.1 mol•L-1的溶液:Na+、K+、SiO32-、NO3- |
15.电视连续剧《大宋提刑官》中的主人公宋慈在案件侦破中常使用“银针验毒”,“银针验毒”的原理是 4Ag+2H2S+O2═2X+2H2O,下列有关说法正确的是( )
| A. | X的化学式为AgS | |
| B. | 银针验毒时,空气中氧气发生氧化反应 | |
| C. | 反应中Ag和H2S均是还原剂 | |
| D. | 每生成1mo1X会转移2mo1电子 |
2.某同学组装了如图所示的电化学装置,则下列说法正确的是( )
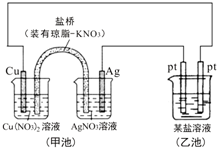

| A. | 图中甲池为原电池装置,Cu电极发生还原反应 | |
| B. | 实验过程中,甲池左侧烧杯中NO3-的浓度不变 | |
| C. | 若甲池中Ag电极质量增加5.4g时,乙池某电极析出1.6g金属,则乙中的某盐溶液可能是AgNO3溶液 | |
| D. | 若用铜制U形物代替“盐桥”,工作一段时间后取出U形物称量,质量会减小 |
19.H、C、N、O、Al、Fe是六种常见元素
(1)Fe位于周期表第四周期,第VIII族,其基态原子未成对电子数为4.碳的同素异形体中,金刚石熔点比C60高(填“高”、“低”).
(2)用“>”或“<”填空:
(3)Al能将污水中NO3-转化为N2,同时铝的反应产物还能净化污水,该反应的离子方程式10Al+6NO3-+18H2O=3N2↑+10Al(OH)3+6OH-;其中产生的铝的化合物能净水的原理是生成的Al(OH)3胶体具有吸附作用.
(4)已知2H2(g)+O2(g)=2H2O(l)△H=-571.66kJ•mol-1
CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(l)△H=-1306.42kJ•mol-1
写出利用CO2和H2合成(CH2=CH2)的热化学方程式为2CO2(g)+6H2(g)═CH2=CH2(g)+4H2O(l)△H=-408.56kJ•mol-1.
(1)Fe位于周期表第四周期,第VIII族,其基态原子未成对电子数为4.碳的同素异形体中,金刚石熔点比C60高(填“高”、“低”).
(2)用“>”或“<”填空:
| 离子半径 | 电负性 | 第一电离能 | 沸点 |
| O2->Al3+ | C<N | N>O | CH4< NH3 |
(4)已知2H2(g)+O2(g)=2H2O(l)△H=-571.66kJ•mol-1
CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(l)△H=-1306.42kJ•mol-1
写出利用CO2和H2合成(CH2=CH2)的热化学方程式为2CO2(g)+6H2(g)═CH2=CH2(g)+4H2O(l)△H=-408.56kJ•mol-1.