题目内容
13.几种短周期元素的原子半径及主要化合价如下表,下列说法正确的是( )| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | -- | -3 | -2 | |
| A. | 元素X和Q形成的化合物中只含有离子键 | |
| B. | X、Z、R的最高价氧化物的水化物之间可两两相互反应 | |
| C. | 用单质Z做的容器不能盛装浓硫酸 | |
| D. | Y的气态氢化物与R的气态氢化物能反应 |
分析 短周期元素中,Q只有最低价-2,没有最高价,故Q为O元素;Y有最高价+7、最低价-1,故Y为Cl;R有+5、-3价,处于ⅤA族,原子半径小于Cl,故R为N元素;X、Z、M最高价分别为+1、+3、+2,则原子半径X>M>Z>Cl,可推知X为Na,Z为Al,M为Mg,据此解答.
解答 解:短周期元素中,Q只有最低价-2,没有最高价,故Q为O元素;Y有最高价+7、最低价-1,故Y为Cl;R有+5、-3价,处于ⅤA族,原子半径小于Cl,故R为N元素;X、Z、M最高价分别为+1、+3、+2,则原子半径X>M>Z>Cl,可推知X为Na,Z为Al,M为Mg.
A.元素X和Q形成的化合物由氧化钠、过氧化钠,过氧化钠中含有离子键、共价键,故A错误;
B.X、Z、R的最高价氧化物的水化物分别为NaOH、Al(OH)3、HNO3,氢氧化钠与硝酸发生中和反应,氢氧化铝属于两性氢氧化物,能与氢氧化钠、硝酸反应,故B正确;
C.常温下,Al再浓硫酸中发生钝化现象,可以用铝制容器盛装浓硫酸,故C错误;
D.Y的气态氢化物为HCl,R的气态氢化物为NH3,二者反应生成NH4Cl,故D正确,
故选BD.
点评 本题考查结构性质位置关系应用,根据化合价、原子半径推断元素是解题关键,注意对周期律的理解掌握.

练习册系列答案
相关题目
3.化学与人类社会的生产、生活有着密切联系.下列叙述中正确的是( )
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 用活性炭为蔗糖脱色和用臭氧漂白纸浆,原理相似 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 |
1.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 58 g乙烯和乙烷的混合气体中碳原子数目一定为4NA | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 142g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA | |
| D. | 已知3BrF3+5H2O=HBrO3+Br2+9HF+O2↑ 如果有5mol H2O参加氧化还原反应,则由水还原的BrF3分子数目为3NA |
8.下列各组离子在溶液中能大量共存的是( )
| A. | K+、OH-、Na+、NO3- | B. | Al3+、AlO2-、HCO3-、Na+ | ||
| C. | Na+、Fe3+、SO42-、I- | D. | Fe3+、SCN-、Na+、CO32- |
18.a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示.
请回答:
(l)d属于d区的元素,其基态原子的价电子排布图为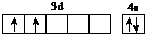 .
.
(2)b与其同周期相邻元素第一电离能由大到小的顺序为N>O>C(用元素符号表示).
(3)c的氢化物水溶液中存在的氢键有4种,任意画出一种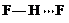 、
、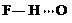 、
、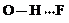 、
、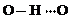 任意一种.
任意一种.
(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为SiO2>CO2(用化学式表示).若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为平面三角形;A的中心原子的轨道杂化类型为sp3杂化;与A互为等电子体的一种分子为SO3(填化学式).
(5)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的 晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为H4Cu3Au,若该晶体的相对分子质量为M,密度为ag/cm3,则晶胞的体积为$\frac{M}{a{N}_{A}}$ cm3(NA用表示阿
伏加德罗常数的值).
| a | 原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| b | 基态原子的p轨道电子数比s轨道电子数少1 |
| c | 在周期表所列元素中电负性最大 |
| d | 位于周期表中第4纵行 |
| e | 基态原子M层全充满,N层只有一个电子 |
(l)d属于d区的元素,其基态原子的价电子排布图为
 .
.(2)b与其同周期相邻元素第一电离能由大到小的顺序为N>O>C(用元素符号表示).
(3)c的氢化物水溶液中存在的氢键有4种,任意画出一种
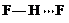 、
、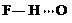 、
、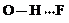 、
、 任意一种.
任意一种.(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为SiO2>CO2(用化学式表示).若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为平面三角形;A的中心原子的轨道杂化类型为sp3杂化;与A互为等电子体的一种分子为SO3(填化学式).
(5)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的 晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为H4Cu3Au,若该晶体的相对分子质量为M,密度为ag/cm3,则晶胞的体积为$\frac{M}{a{N}_{A}}$ cm3(NA用表示阿
伏加德罗常数的值).
5.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1NH4HCO3溶液:K+、Na+、SO42-、OH- | |
| B. | 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | |
| C. | 0.1 mol•L-1CH3COONa溶液:Mg2+、H+、Cl-、SO42- | |
| D. | Kw/c(H+)=0.1 mol•L-1的溶液:Na+、K+、SiO32-、NO3- |
2.某同学组装了如图所示的电化学装置,则下列说法正确的是( )
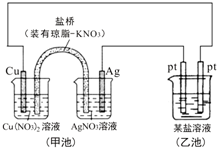

| A. | 图中甲池为原电池装置,Cu电极发生还原反应 | |
| B. | 实验过程中,甲池左侧烧杯中NO3-的浓度不变 | |
| C. | 若甲池中Ag电极质量增加5.4g时,乙池某电极析出1.6g金属,则乙中的某盐溶液可能是AgNO3溶液 | |
| D. | 若用铜制U形物代替“盐桥”,工作一段时间后取出U形物称量,质量会减小 |
3.电解NO制备NH4NO3,其工作原理如图所示,下列说法不正确的是( )
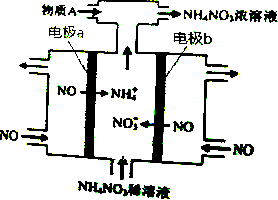

| A. | b极的电极反应为:NO-3e-+4OH-=NO${\;}_{3}^{-}$+2H2O | |
| B. | 溶液中的H+由电极b处向电极a处迁移 | |
| C. | 电解过程总反应的化学方程式为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3 | |
| D. | 为使电解产物全部转化为NH4NO3,需补充的物质A是NH3 |