题目内容
8.运用元素周期律分析下面的推断正确的是( )| A. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| B. | 砹单质是一种有色固体,砹化氢很不稳定,砹化银是难溶于水的白色沉淀 | |
| C. | 碳酸铯受热易分解 | |
| D. | 硒化氢是无色、有毒、比硫化氢稳定的气体 |
分析 A.碱金属元素从上到下元素的金属性逐渐增强;
B.非金属性越弱,气态氢化物越不稳定,AgI为黄色固体,结合递变规律分析;
C.金属性越强的金属,其碳酸盐越难以分解;
D.S非金属性比Se的强.
解答 解:A.碱金属元素从上到下元素的金属性逐渐增强,对应的单质与氧气反应的产物有氧化物、过氧化物、超氧化物等,越来越复杂,故A正确;
B.非金属性越弱,气态氢化物越不稳定,AgI为黄色固体,则砹单质是一种有色固体,砹化氢很不稳定,砹化银是难溶于水的有色沉淀,故B错误;
C.金属性越强的金属,其碳酸盐越难以分解,铯的金属性最强,碳酸铯加热不分解,故C错误;
D.S非金属性比Se的强,则硒化氢是无色、有毒、不如硫化氢稳定的气体,故D错误;
故选A.
点评 本题考查元素周期表和周期律的综合应用,为高频考点,把握元素的位置、性质及元素周期律的应用为解答的关键,侧重分析与应用能力的考查,注意递变规律及对角线规则,题目难度不大.

练习册系列答案
相关题目
19.二氧化硫是引起酸雨的一种物质.二氧化硫属于( )
| A. | 酸 | B. | 氧化物 | C. | 碱 | D. | 混合物 |
16.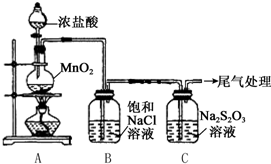 某小组用如图所示装置对Cl2与Na2S2O3的反应进行探究(气密性已检验).
某小组用如图所示装置对Cl2与Na2S2O3的反应进行探究(气密性已检验).
实验操作和现象:
查阅资料:a.S2O32-有较强的还原性
b.酸性条件下S2O32-迅速分解为S和SO2
(1)A中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B中饱和NaCl溶液的作用是除去Cl2中的HCl,防止对Cl2与Na2S2O3的反应产生干扰.
(3)C中生成黄色沉淀的离子方程式是S2O32-+2H+=S↓+SO2↑+H2O.
(4)为检验C中是否有SO2生成,需进行的操作是把白雾通入Ba(NO3)2溶液中,若有白色沉淀,证明有SO2生成.
(5)C中滤液与氯化钡溶液反应生成白色沉淀,甲同学认为利用该现象可证明Na2S2O3被Cl2氧化,反应的离子方程式是S2O32-+4Cl2+5H2O=8Cl-+2SO42-+10H+.
(6)乙同学认为,C中滤液用硝酸酸化后滴加硝酸银溶液,若有白色沉淀,也能证明Na2S2O3被Cl2氧化,丙同学认为不能证明,理由是氯气与水反应也能生成Cl-,所以检验出溶液中有Cl-也不能证明是Cl2氧化了Na2S2O3.
 某小组用如图所示装置对Cl2与Na2S2O3的反应进行探究(气密性已检验).
某小组用如图所示装置对Cl2与Na2S2O3的反应进行探究(气密性已检验).实验操作和现象:
| 操作 | 现象 |
| 打开分液漏斗活塞,滴加一定量浓盐酸,加热 | i.A中有黄绿色气体生成,C中液面上方有白雾,溶液中开始出现少量浑浊; ii.一段时间后,C中产生大量黄色沉淀. |
| 用湿润的淀粉碘化钾试纸检验C中白雾 | 淀粉碘化钾试纸变蓝 |
| C中浊液过滤后,取少量滤液用盐酸酸化,滴加氯化钡溶液 | 有白色沉淀生成 |
b.酸性条件下S2O32-迅速分解为S和SO2
(1)A中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B中饱和NaCl溶液的作用是除去Cl2中的HCl,防止对Cl2与Na2S2O3的反应产生干扰.
(3)C中生成黄色沉淀的离子方程式是S2O32-+2H+=S↓+SO2↑+H2O.
(4)为检验C中是否有SO2生成,需进行的操作是把白雾通入Ba(NO3)2溶液中,若有白色沉淀,证明有SO2生成.
(5)C中滤液与氯化钡溶液反应生成白色沉淀,甲同学认为利用该现象可证明Na2S2O3被Cl2氧化,反应的离子方程式是S2O32-+4Cl2+5H2O=8Cl-+2SO42-+10H+.
(6)乙同学认为,C中滤液用硝酸酸化后滴加硝酸银溶液,若有白色沉淀,也能证明Na2S2O3被Cl2氧化,丙同学认为不能证明,理由是氯气与水反应也能生成Cl-,所以检验出溶液中有Cl-也不能证明是Cl2氧化了Na2S2O3.
13.破坏1molH-H键、Cl-Cl键和H-Cl键分别需要吸收436kJ、243kJ和431kJ的能量,请用此数据估计,由Cl2和H2反应生成2molHCl时总的过程需要放热(填吸或放)183KJ.
20.有机物原子的共线及共面问题比较重要.在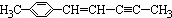 分子中,可能处于同一平面上的原子数最多为( )
分子中,可能处于同一平面上的原子数最多为( )
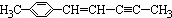 分子中,可能处于同一平面上的原子数最多为( )
分子中,可能处于同一平面上的原子数最多为( )| A. | 12个 | B. | 22个 | C. | 16个 | D. | 20个 |
17.某粒子用ZARn+表示,下列关于该粒子的叙述中,正确的是( )
| A. | 所含的质子数=A-n | B. | 所含电子数=Z+n | ||
| C. | 所含的中子数=A-Z | D. | 质量数=Z+A |
18.某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,标况下用排水集气法收集反应放出的氢气,实验记录如下(累计值)
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大2~3 min.
(2)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)0.1mol/(L•min).
(3)除本实验测定反应速率的方法外,可行的方案还有相同时间内测定生成H2的体积(或相同时间内测定Zn的质量)(其他合理答案均可)(写出一种).
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(2)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)0.1mol/(L•min).
(3)除本实验测定反应速率的方法外,可行的方案还有相同时间内测定生成H2的体积(或相同时间内测定Zn的质量)(其他合理答案均可)(写出一种).
 ,工业合成路线如下:
,工业合成路线如下:

 .(R-代表烃基)
.(R-代表烃基)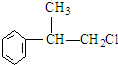 、
、 ;
;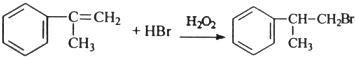 ;
;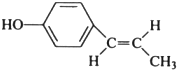 (只写反式结构).
(只写反式结构). (代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
 的名称1,2-二甲苯(或邻二甲苯),D的核磁共振氢谱有3组峰,DMP的分子式为C10H10O4.
的名称1,2-二甲苯(或邻二甲苯),D的核磁共振氢谱有3组峰,DMP的分子式为C10H10O4.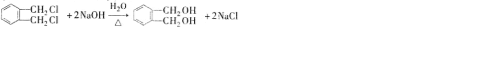 .
.