题目内容
5.如图是几种烷烃分子的球棍模型: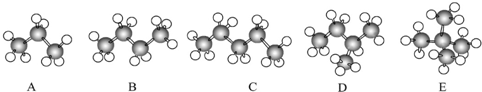
(1)A、B、E三种烷烃的关系为同系物,C、D、E的关系为同分异构体.
(2)用习惯命名法命名:D异丁烷.
(3)E的一氯代物有1种,请写出它们的结构简式:CH2ClC(CH3)3.
分析 (1)三者的关系为碳原子数不同的烷烃判断;CDE三者的关系是分子式相同,结构不同;
(2)丁烷有2种同分异构体,铵习惯命名法分别命名为正丁烷和异丁烷;
(3)分子中有几种不同化学环境的H原子,就有几种一氯代物,据此解答即可.
解答 解:(1)ABE三者结构相似,分子组成上相差1个或多个CH2原子团,属于同系物;CDE三者分子式相同,结构不同,属于同分异构体,故答案为:同系物;同分异构体;
(2)丁烷有2种同分异构体,分别为正丁烷和异丁烷,其中D带有一个支链,属于异丁烷,故答案为:异丁烷;
(3)E为新戊烷,其中四个甲基上的12个H是等同的,故只有1种一氯代物,结构简式为:CH2ClC(CH3)3,故答案为:1;CH2ClC(CH3)3.
点评 本题考查了烷烃及其命名、同分异构体等知识,题目难度中等,充分考查了学生的分析、理解能力和灵活应用所学知识的能力.

练习册系列答案
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
16. 某小组用如图所示装置对Cl2与Na2S2O3的反应进行探究(气密性已检验).
某小组用如图所示装置对Cl2与Na2S2O3的反应进行探究(气密性已检验).
实验操作和现象:
查阅资料:a.S2O32-有较强的还原性
b.酸性条件下S2O32-迅速分解为S和SO2
(1)A中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B中饱和NaCl溶液的作用是除去Cl2中的HCl,防止对Cl2与Na2S2O3的反应产生干扰.
(3)C中生成黄色沉淀的离子方程式是S2O32-+2H+=S↓+SO2↑+H2O.
(4)为检验C中是否有SO2生成,需进行的操作是把白雾通入Ba(NO3)2溶液中,若有白色沉淀,证明有SO2生成.
(5)C中滤液与氯化钡溶液反应生成白色沉淀,甲同学认为利用该现象可证明Na2S2O3被Cl2氧化,反应的离子方程式是S2O32-+4Cl2+5H2O=8Cl-+2SO42-+10H+.
(6)乙同学认为,C中滤液用硝酸酸化后滴加硝酸银溶液,若有白色沉淀,也能证明Na2S2O3被Cl2氧化,丙同学认为不能证明,理由是氯气与水反应也能生成Cl-,所以检验出溶液中有Cl-也不能证明是Cl2氧化了Na2S2O3.
 某小组用如图所示装置对Cl2与Na2S2O3的反应进行探究(气密性已检验).
某小组用如图所示装置对Cl2与Na2S2O3的反应进行探究(气密性已检验).实验操作和现象:
| 操作 | 现象 |
| 打开分液漏斗活塞,滴加一定量浓盐酸,加热 | i.A中有黄绿色气体生成,C中液面上方有白雾,溶液中开始出现少量浑浊; ii.一段时间后,C中产生大量黄色沉淀. |
| 用湿润的淀粉碘化钾试纸检验C中白雾 | 淀粉碘化钾试纸变蓝 |
| C中浊液过滤后,取少量滤液用盐酸酸化,滴加氯化钡溶液 | 有白色沉淀生成 |
b.酸性条件下S2O32-迅速分解为S和SO2
(1)A中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B中饱和NaCl溶液的作用是除去Cl2中的HCl,防止对Cl2与Na2S2O3的反应产生干扰.
(3)C中生成黄色沉淀的离子方程式是S2O32-+2H+=S↓+SO2↑+H2O.
(4)为检验C中是否有SO2生成,需进行的操作是把白雾通入Ba(NO3)2溶液中,若有白色沉淀,证明有SO2生成.
(5)C中滤液与氯化钡溶液反应生成白色沉淀,甲同学认为利用该现象可证明Na2S2O3被Cl2氧化,反应的离子方程式是S2O32-+4Cl2+5H2O=8Cl-+2SO42-+10H+.
(6)乙同学认为,C中滤液用硝酸酸化后滴加硝酸银溶液,若有白色沉淀,也能证明Na2S2O3被Cl2氧化,丙同学认为不能证明,理由是氯气与水反应也能生成Cl-,所以检验出溶液中有Cl-也不能证明是Cl2氧化了Na2S2O3.
13.破坏1molH-H键、Cl-Cl键和H-Cl键分别需要吸收436kJ、243kJ和431kJ的能量,请用此数据估计,由Cl2和H2反应生成2molHCl时总的过程需要放热(填吸或放)183KJ.
20.有机物原子的共线及共面问题比较重要.在 分子中,可能处于同一平面上的原子数最多为( )
分子中,可能处于同一平面上的原子数最多为( )
 分子中,可能处于同一平面上的原子数最多为( )
分子中,可能处于同一平面上的原子数最多为( )| A. | 12个 | B. | 22个 | C. | 16个 | D. | 20个 |
17.某粒子用ZARn+表示,下列关于该粒子的叙述中,正确的是( )
| A. | 所含的质子数=A-n | B. | 所含电子数=Z+n | ||
| C. | 所含的中子数=A-Z | D. | 质量数=Z+A |
14.既能跟盐酸反应又能跟NaOH溶液反应的化合物是( )
| A. | Al | B. | Al2O3 | C. | Fe | D. | Fe2O3 |
15.已知A2+、B+、C3-、D-是第三周期元素的四种离子.下列叙述中正确的是( )
| A. | 四种离子都具有相同的电子层结构 | |
| B. | 原子半径:r(D)>r(C)>r(A)>r(B) | |
| C. | 离子半径:r(B+)>r(A2+)>r(C3-)>r(D-) | |
| D. | B、D两元素的最高价氧化物的水化物在溶液中反应的离子方程式可表示为H++OH-=H2O |