题目内容
1.(1)已知25℃时,NaOH溶液和NaCN溶液pH均为11.则:①NaOH溶液中由水电离出的c(OH-)与NaCN溶液中由水电离出的c(OH-)的比为1:108.
②各取5ml上述两种溶液,分别加入水稀释至50ml,pH较大的是NaCN溶液.
③常温下将NaOH稀溶液与HCN稀溶液混合,不可能出现的结果是ABD
A.pH>7,且c(OH-)>c(Na+)>c(H+)>c(CN-)
B.pH>7,且c(Na+)>c(OH-)>c(H+)>c(CN-)
C.pH<7,且c(CN-)>c(H+)>c(Na+)>c (OH-)
D.pH=7,且c(CN-)>c(Na+)>c(H+)=c(OH-)
(2)已知常温,AgBr的Ksp=4.9×10-13、AgI的Ksp=8.3×10-17.向含有NaBr、KI均为0.002mol•L-1的溶液中加入等体积的浓度为4×10-3mol•L-1AgNO3溶液,则产生的沉淀是AgI、AgBr(填化学式);若向其中再加入适量的NaI固体,则最终可发生沉淀转化的总反应离子方程式表示为AgBr(s)+I-(aq)═AgI(s)+Br-(aq).
(3)Cu(OH)2在水中存在着如下沉淀溶解平衡:Cu(OH)2(s)?Cu2+(aq)+2OH-(aq),在常温下,
Ksp=2×10-20.某CuSO4溶液中,c(Cu2+)=0.02mol•L-1,在常温下如果要生成Cu(OH)2沉淀,需要向CuSO4溶液中加入碱溶液来调整pH(假设溶液体积不变),使溶液的pH大于5.
分析 (1)①NaOH中的氢离子浓度已知,这一部分全部由水电离出来,水电离出来的氢离子等于氢氧根离子,所以氢氧化钠中有水电离出的氢氧根离子浓度为10-11mol/l;NaCN中CN-水解,使溶液显碱性,所以溶液中氢氧根离子的浓度可认为全部由水电离出来,Kw一定,可知其浓度为10-3mol/l;
②各取5ml上述两种溶液,分别加水稀释至50ml,促进NaCN的水解,所以pH减小不到一个单位,pH较大的是NaCN;
③A.pH>7,说明溶液呈碱性,如NaOH过量,可存在c(Na+)>c(OH-)>c(CN-)>c(H+);
B.pH>7,且c(Na+)>c(OH-)>c(H+)>c(CN-),电荷不守恒;
C.pH<7,说明HCN过量,所以离子浓度大小可能为:c(CN-)>c(H+)>c(Na+)>c (OH-);
D.电荷不守恒;
(2)根据Ksp(AgBr),Ksp(AgI)的相对大小分析解答;
(3)在常温下如果要生成Cu(OH)2沉淀,应满足c(Cu2+)×c2(OH-)≥2×10-20,以此计算溶液的c(OH-),可确定溶液的pH.
解答 解:(1)①NaOH中的氢离子浓度已知,这一部分全部由水电离出来,水电离出来的氢离子等于氢氧根离子的c(OH-)的比为1:108,故答案为:1:108;
②各取5ml上述两种溶液,分别加水稀释至50ml,促进NaCN的水解,所以pH减小不到一个单位,pH较大的是NaCN,故答案为:NaCN;
③A.pH>7,说明溶液呈碱性,如NaOH过量,可存在c(Na+)>c(OH-)>c(CN-)>c(H+),钠离子的浓度应大于氢氧根离子的浓度,故错误;
B.pH>7,且c(Na+)>c(OH-)>c(H+)>c(CN-),电荷不守恒,故错误;
C.pH<7,说明HCN过量,所以离子浓度大小可能为:c(CN-)>c(H+)>c(Na+)>c (OH-),故正确;
D.电荷不守恒,故错误;
故选:ABD;
(2)等体积混合后c(Br-)=c(I-)=0.001mol/L,c(Ag+)=2×10-3 mol/L.因Ksp(AgI)<Ksp(AgBr),AgI先沉淀,当I-完全沉淀时,消耗c(Ag+)=c(I-)=0.001mol/L,剩余c(Ag+)=2×10-3 mol/L-0.001mol/L=0.001mol/L,Q(AgBr)=0.001mol/L×0.001mol/L=1×10-6>4.9×10-13,所以有AgBr沉淀生成;而再向其中加入适量NaI固体时,会有AgBr转化为AgI.
故答案为:AgI、AgBr;AgBr(s)+I-(aq)═AgI(s)+Br-(aq);
(3)已知Ksp=2×10-20,c(Cu2+)=0.02mol•L-1,在常温下如果要生成Cu(OH)2沉淀,则c(Cu2+)×c2(OH-)≥2×10-20,所以c(OH-)≥$\sqrt{\frac{2×1{0}^{-20}}{0.02}}$=10-9(mol/L),应调节溶液pH大于5,故答案为:5.
点评 本题考查离子浓度大小的比较、沉淀溶解平衡原理、沉淀转化的原理、影响沉淀溶解平衡的因素,侧重于浓度的计算,题目难度不大,注意把握计算公式的运用.题目难度较大.

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案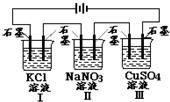 如图装置电解一段时间,当某极析出0.32gCu时,I、Ⅱ、Ⅲ中溶液pH分别为 (溶液足量,体积均为100mL且电解前后溶液体积变化及气体的溶解忽略不计)( )
如图装置电解一段时间,当某极析出0.32gCu时,I、Ⅱ、Ⅲ中溶液pH分别为 (溶液足量,体积均为100mL且电解前后溶液体积变化及气体的溶解忽略不计)( )| A. | 13、7、1 | B. | 12、7、2 | C. | 1、7、13 | D. | 7、13、1 |
| A. | Na2O2能与CO2反应,可用作呼吸面具的供氧剂 | |
| B. | 硅是半导体材料,可用于制备光导纤维 | |
| C. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| D. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 |
| A. | 两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前10号元素中,满足上述关系的元素共有2对 | |
| B. | 某元素能形成+7价的含氧酸及其盐,则该元素一定为主族元素 | |
| C. | L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等 | |
| D. | 同主族两种短周期元素原子序数之差不可能是2 |
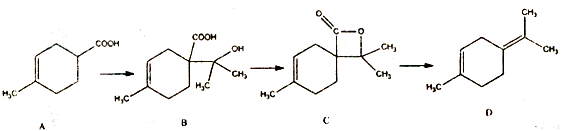
下列说法正确的是( )
| A. | 1mol有机物B分别于足量的Na和Na2CO3溶液反应,分别生成lmolH2 和lmolCO2 | |
| B. | 有机物B的分子式为C11H18O3,它能发生取代、加成和消去反应 | |
| C. | 有机物c所有同分异构体中不可能有芳香族化合物存在 | |
| D. | 有机物D分子中所有碳原子一定共面 |
 .
. .
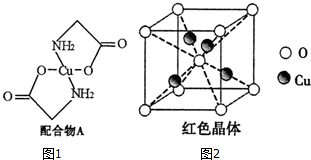
.
 .
.