题目内容
16.下列说法正确的是( )| A. | 两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前10号元素中,满足上述关系的元素共有2对 | |
| B. | 某元素能形成+7价的含氧酸及其盐,则该元素一定为主族元素 | |
| C. | L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等 | |
| D. | 同主族两种短周期元素原子序数之差不可能是2 |
分析 A、短周期元素中,两种元素原子的核外电子层数之比情况:1:1;1:2;1:3;2:3.据此确定最外层电子数.进而确定元素组合.短周期元素中满足元素原子的核外电子层数之比与最外层电子数之比相等有H、Be;He、C;H、Al;He、S;Be、Al;C、S,所以前10号元素为H、Be;He、C;
B、过渡元素中一些金属元素可以形成+7价的含氧酸及其盐;
C、L层电子为偶数的主族元素有铍、碳、氧或第三周期元素主族元素等;
D、氢与锂原子序数之差2.
解答 解:A、短周期元素中,两种元素原子的核外电子层数之比情况:1:1;1:2;1:3;2:3.据此确定最外层电子数.进而确定元素组合.短周期元素中满足元素原子的核外电子层数之比与最外层电子数之比相等有H、Be;He、C;H、Al;He、S;Be、Al;C、S,所以前10号元素为H、Be;He、C,故A正确;
B、过渡元素中一些金属元素可以形成+7价的含氧酸及其盐,如Mn元素可以形成高锰酸、高锰酸钾,故B错误;
C、L层电子为偶数的主族元素有铍、碳、氧或第三周期元素主族元素等,若为Na,则所在族的序数与该元素原子的L层电子数不相等,故C错误;
D、氢的原子序数为1与锂原子序数为3,两者之差2,故D错误;
故选A.
点评 本题考查元素周期表的结构及应用,为高频考点,把握原子结构与元素位置的关系为解答的关键,明确原子的电子层数与最外层电子数是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
4.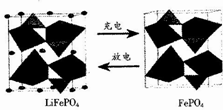 LiFePO4是锂离子电池一种电极材料,其结构稳定、资源丰富、安全性能好、无毒.该电极材料在充放电时的变化如图所示,下列有关说法正确的是( )
LiFePO4是锂离子电池一种电极材料,其结构稳定、资源丰富、安全性能好、无毒.该电极材料在充放电时的变化如图所示,下列有关说法正确的是( )
 LiFePO4是锂离子电池一种电极材料,其结构稳定、资源丰富、安全性能好、无毒.该电极材料在充放电时的变化如图所示,下列有关说法正确的是( )
LiFePO4是锂离子电池一种电极材料,其结构稳定、资源丰富、安全性能好、无毒.该电极材料在充放电时的变化如图所示,下列有关说法正确的是( )| A. | 放电时该电极为负极 | |
| B. | 充电是Li+向阳极移动 | |
| C. | 充电时该电极发生氧化反应,反应式为LiFePO4-e-=FePO4+Li+ | |
| D. | 该电池可以用磷酸溶液作电解质 |
5.下列有关物质性质与应用对应关系错误的是( )
| A. | 常温下,浓硫酸能使铝钝化,可用铝制容器贮运浓硫酸 | |
| B. | 二氧化硅熔点很高、硬度很大,可用于制造坩埚 | |
| C. | 氯化铁溶液能腐蚀铜,可用于制作印刷电路板 | |
| D. | 金属钠硬度小、密度小,可用于制造高压钠灯 |
6.有关如图所示的有机物的说法不正确的是( )
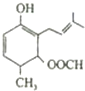

| A. | 该有机物可以与NaOH溶液反应 | |
| B. | 该有机物的分子式为C13H19O3 | |
| C. | 该有机物既可以发生氧化反应又能发生还原反应 | |
| D. | 该有机物和丙三醇不互为同系物 |