题目内容
6.(1)某气态有机物X含C、H、O三种元素,已知下列条件,现欲确定X的分子式,所需的条件最佳组合是①②④.(填相应的数字序号)①X中含碳质量分数 ②X中含氢质量分数 ③X在标准状况下的体积 ④质谱确定X的相对分子质量 ⑤X的质量.
(2)将6g某有机物A完全燃烧,生成CO2和H2O,将产物通过浓H2SO4增重7.2g,再通过碱石灰,碱石灰增重13.2g.则该有机物的实验式为C3H8O.
(3)科学家最近在-100℃的低温下合成了一种烃X,其分子式为C5H4,红外光谱和核磁共振氢谱表明其分子中的氢原子所处的化学环境没有区别,则该分子的结构简式为
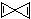 .
.
分析 (1)先确定该有机物的实验式,再根据相对分子质量确定分子式;
(2)根据浓硫酸和碱石灰增重的质量可计算有机物生成的水和二氧化碳的物质的量,根据C元素、H元素守恒和O元素守恒可计算有机物中C、H、O元素的物质的量,进而确定其实验式;
(3)根据X的分子式及“红外光谱和核磁共振氢谱表明其分子中的氢原子所处的化学环境没有区别”确定X的结构简式.
解答 解:(1)根据①②可以确定氧元素的质量分数,进一步可以确定该有机物的实验式,由④可以确定有机物分子的相对分子质量.综上所述,最终可以确定有机物的分子式的最佳组合为:①②④,
故答案为:①②④;
(2)浓硫酸增重可知水的质量为7.2g,则水的物质的量为:n(H2O)=$\frac{7.2g}{18g/mol}$=0.4mol,n(H)=0.8mol,m(H)=0.8g;碱石灰增重13.2g,可知二氧化碳质量为13.2g,则:n(C)=n(CO2)=$\frac{13.2g}{44g/mol}$=0.3mol,m(C)=3.6g,
由于m(C)+m(H)=4.4g,有机物的质量为6g,所以有机物中氧的质量为:1.6g,n(O)=$\frac{1.6g}{16g/mol}$=0.1mol,
所以:n(C):n(H):n(O)=0.3mol:0.8mol:0.1mol=3:8:1,
则该有机物的实验式为:C3H8O,
故答案为:C3H8O;
(3)X的分子式为C5H4,其不饱和度为:$\frac{5×2+2-4}{2}$=4;红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,说明其分子中所有的H原子都是等效的,则X具有对称结构,结合不饱和度为4可知X的结构简式为: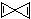 ,
,
故答案为: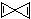 .
.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握质量守恒定律在确定有机物分子式中的应用.

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案| A. | CH3COOCH2CH3+H2O $\stackrel{催化剂△}{→}$ CH3CH2OH+CH3COOH | |
| B. | CH2=CH2+HCl$→_{△}^{一定条件}$CH3CH2Cl | |
| C. | 2CH3CH2OH+O2$\stackrel{Cu}{→}$2CH3CHO+2H2O | |
| D. | 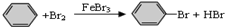 |
 (1)已知元素M是组成物质NH4Al(SO4)2的一种元素.元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如表所示:
(1)已知元素M是组成物质NH4Al(SO4)2的一种元素.元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如表所示:| I1 | I2 | I3 | I4 | |
| 电离能(kJ/mol) | 578 | 1817 | 2745 | 11578 |
(2)不同元素的原子在分子内吸引电子的能力大小可用电负性来表示,下面是某些短周期元素电负性:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性 | 1.0 | 1.57 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.61 | 1.8 | 2.1 | 2.5 | 3.0 |
②某有机化合物结构式为
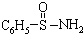 ,其中S-N中,你认为共用电子对偏向谁?氮(写原子名称)
,其中S-N中,你认为共用电子对偏向谁?氮(写原子名称)③已知元素电负性的差值一般大于1.7时,原子间形成离子键,小于该值则原子间形成共价键,请指出下列原子之间形成的化学键是离子键还是共价键.Be和F离子键,Si和Cl共价键.
(3)工业上冶炼Z时用到的催化剂是冰晶石,制取冰晶石(Na3AlF6)的化学方程式如下:
2Al(OH)3+12HF+3A═2Na3AlF6+3CO2↑+9H2O
①反应物A的化学式为 Na2CO3,属于离子晶体
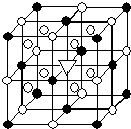
②冰晶石(Na3AlF6)是离子化合物,由两种微粒构成,冰晶石晶胞结构如图所示,“●”位于大立方体顶点和面心,“○”位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处“▽”所代表的微粒是Na+(填具体的微粒符号)
③若Na3AlF6的摩尔质量为Mg/mol,若该晶胞的边长为acm,密度为ρg/cm3,设NA表示阿伏伽德罗常数,则NA=$\frac{4M}{ρ{a}^{3}}$/mol(用M、a、ρ表示).
| A. | 第VIIA族元素由上至下其单质的沸点依次升高 | |
| B. | 第VIA族元素的最高化合价都为+6价 | |
| C. | 离核越远的电子层上的电子能量越低 | |
| D. | 所有元素的原子中都含有中子 |
| 选项 | 被提纯的物质(杂质) | 除杂试剂 | 分离方法 |
| A | KNO3(NaCl) | H2O | 重结晶 |
| B | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
| C | 乙醇(水) | 生石灰 | 蒸馏 |
| D | 溴苯(溴) | H2O | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 118号元素属于第八周期元素 | |
| B. | 118号元素是一种金属元素 | |
| C. | 118号元素的原子核中含有118个质子 | |
| D. | 118号元素原子经化学反应后可转化成其他元素的原子 |