题目内容
11.将3a L NO2气体依次通过盛有下列物质的容器:饱和NaHCO3溶液、浓硫酸、固体Na2O2,发生反应的化学方程式是:(1)3NO2+H2O=2HNO3+NO,
(2)HNO3+NaHCO3=NaNO3+CO2↑+H2O,
(3)2CO2+2Na2O2═2Na2CO3+O2.
最后用排水法收集残余气体,收集到的气体是O2,体积是0.25aL.
分析 假定为3amolNO2,通过饱和碳酸氢钠溶液,首先发生3NO2+H2O=2HNO3+NO,生成amolNO和2amolHNO3,再发生反应:HNO3+NaHCO3=NaNO3+CO2↑+H2O,生成2amolCO2,从饱和碳酸氢钠溶液出来的气体为amolNO、2amolCO2及水蒸气,再通过浓硫酸干燥,出来的气体为amolNO、2amolCO2,气体通过过氧化钠,发生反应2CO2+2Na2O2═2Na2CO3+O2、2NO+O2=2NO2,从过氧化钠出来的气体最终为0.5amolO2、amolNO2,最后用排水法收集,发生反应4NO2+O2+2H2O=4HNO3,据此计算解答.
解答 解:假定为3amolNO2,通过饱和碳酸氢钠溶液,首先发生3NO2+H2O=2HNO3+NO,生成amolNO、2amolHNO3,再发生反应:HNO3+NaHCO3=NaNO3+CO2↑+H2O,生成2amolCO2,从饱和碳酸氢钠溶液出来的气体为amolNO、2amolCO2及水蒸气,再通过浓硫酸干燥,出来的气体为amolNO、2amolCO2,气体通过过氧化钠,发生反应2CO2+2Na2O2═2Na2CO3+O2,生成amolO2,再发生反应2NO+O2=2NO2,amolNO消耗0.5amolO2,生成amolNO2,故从过氧化钠出来的气体最终为0.5amolO2、amolNO2,最后用排水法收集,发生反应4NO2+O2+2H2O=4HNO3,amolNO2消耗O2为amol×$\frac{1}{4}$=0.25amol,故最终剩余的氧气为0.5amol-0.25amol=0.25amol,体积之比等于物质的量之比,所以最终收集到的气体是0.25a的O2,
故答案为:3NO2+H2O=2HNO3+NO;HNO3+NaHCO3=NaNO3+CO2↑+H2O;2CO2+2Na2O2═2Na2CO3+O2;O2;0.25a.
点评 本题考查混合物的有关计算、根据方程式进行的计算,题目涉及的反应较多、过程复杂,计算量较大,需要学生细心计算,题目难度中等,清楚发生的反应是解题的关键.

| A. | HD、H2O、NH3均为化合物 | |
| B. | CH2O2、C3H6O2、C4H8O2一定互为同系物 | |
| C. | HCOOCH3、CH3COOH、HOCH2CHO互为同分异构体 | |
| D. | SiO2、NaCl、S8、Cu均是能表示物质分子组成的分子式 |
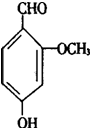 它有宜人的气味,存在于香草豆、香脂、安息香、丁子油和香茅油中,是制作巧克力的辅助原料,下列关于香兰素的判断不正确的是( )
它有宜人的气味,存在于香草豆、香脂、安息香、丁子油和香茅油中,是制作巧克力的辅助原料,下列关于香兰素的判断不正确的是( )| A. | 可与银氨溶液反应 | B. | 可与氢氧化钠溶液反应 | ||
| C. | 可与浓溴水发生取代反应 | D. | 分子中所有原子都在同一平面 |
| A. | 浓氨水和浓HNO3 | B. | 浓氨水和浓盐酸 | C. | 浓氨水和浓H2SO4 | D. | 浓氨水和浓H3PO4 |
| A. | CH3COOCH2CH3+H2O $\stackrel{催化剂△}{→}$ CH3CH2OH+CH3COOH | |
| B. | CH2=CH2+HCl$→_{△}^{一定条件}$CH3CH2Cl | |
| C. | 2CH3CH2OH+O2$\stackrel{Cu}{→}$2CH3CHO+2H2O | |
| D. |  |
| A. | 氢氧化钡溶液与过量稀硫酸反应:OH-+Ba2++SO42-+H+=BaSO4↓+H2O | |
| B. | 碳酸氢钙与过量的NaOH 溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- | |
| C. | 氯化铝溶液与过量的氨水反应:Al3++4OH-=AlO2-+2H2O | |
| D. | 稀硝酸与过量的铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O |
 .
.