题目内容
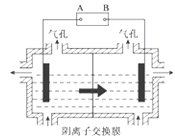
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
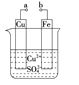
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-===Cu
C.无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D.a和b连接时,铜片上发生氧化反应
【答案】D
【解析】
试题分析:A.a和b不连接时,铁直接和硫酸铜发生置换反应,析出铜,A项正确;B.a和b用导线连接时,则构成原电池,铁是负极,失去电子,铜是正极,溶液中的铜离子得到电子而析出铜,B项正确;C.根据以上分析可知,无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色,C项正确;D.a和b连接时,在原电池中铜是正极,溶液中的铜离子得到电子而析出铜,发生的是还原反应,D项错误;答案选D。

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
【题目】短周期元素 W、X、Y、Z 在元素周期表中的位置如右图所示。其中 Z 的单质是一种重要半导体材料,广泛应用于电子工业的各个领域。
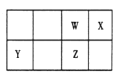
(1)W 在元素周期表中的位置是____________。
(2)W、X、氢元素形成的三原子分子的电子式____________。
(3)下列选项中,能证明元素非金属性X强于W的是____________。
A.相对原子质量:X>W | B.最低化合价:X>W |
C.最简单氢化物的稳定性:X>W | D.最高价氧化物的水化物酸性:X>W |
(4)元素周期表中与 Z 同周期的某金属元素形成的单质 A,可发生如下图所示的转化:
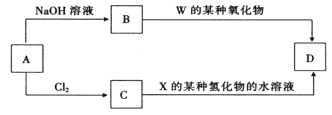
其中化合物D是一种白色沉淀,则 B 中溶质的化学式为____________;
B与 C也可直接转化生成 D 写出对应的离子方程式为____________。