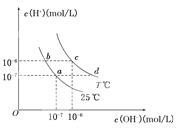
题目内容
【题目】【化学—物质结构与性质】原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29。
(1)F原子基态的外围核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是 (用元素符号回答)。
(3)元素B的简单气态氢化物的沸点 (高于,低于)元素A的简单气态氢化物的沸点,其主要原因是 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。
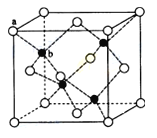
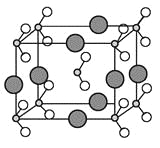
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。
(7)FC在加热条件下容易转化为F2C,从原子结构的角度解释原因 。
【答案】(1)[Ar]3d104s1 (2)N>O>C (3)高于
B的氢化物分子之间存在氢键 (4)[N=C=O]- (5)sp
(6)NaNO2 (7)Cu+外围电子3d10轨道全满稳定,Cu2+外围电子3d9轨道电子非全满和半满状态不稳定,所以CuO在加热条件下容易转化为Cu2O
【解析】试题分析:原子序数依次增大的A、B、C、D、E、F六种元素,A的基态原于有3个不同的能级,各能级中的电子数相等,则A是C元素;C的基态原子2p能级上的未成对电子数与A原子的相同,C原子序数大于A,则C为O元素;B原子序数大于A而小于C,则B是N元素;E和C位于同一主族,且E原子序数小于29,则C是S元素;D为它所在周期中原子半径最大的主族元素,原子序数小于S,则D是Na元素;F的原子序数为29,为Cu元素;
(1)F是Cu元素,其原子核外有29个电子,根据构造原理知Cu元素基态原子的核外电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1;
(2)A、B、C分别是C、N、O元素,同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以电离能从小到大顺序是N>O>C;
(3)含有氢键的氢化物熔点较高,氨气分子中含有氢键、甲烷中不含氢键,所以氨气熔沸点高于甲烷;
(4)等电子体原子个数相等、价电子数相等,由C、N、O形成的离子OCN-与CO2互为等电子体,根据二氧化碳结构式知OCN-的结构简式为[N=C=O]-;
(5)在元素C与S所形成的常见化合物CS2中,二硫化碳分子中中心原子价层电子对个数是2且不含孤电子对,所以C原子采用sp杂化;
(6)由N、O、Na三种元素形成的化合物晶体的晶胞如图所示,该晶胞中N原子个数=1+8×1/8=2、O原子个数=2+16×1/8=4,Na原子个数=8×1/4=2,所以该晶胞中Na、N、O原子个数之比=2:2:4=1:1:2,则化学式为NaNO2;
(7)在原子中电子层全满、半满和全空为稳定状态,Cu+外围电子3d10轨道全满稳定,Cu2+外围电子3d9轨道电子非全满和半满状态不稳定,所以CuO在加热条件下容易转化为Cu2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】有些古文或谚语包含了丰富的化学知识。下列解释错误的是
选项 | 古文或谚语 | 化学解释 |
A | 日照香炉生紫烟 | 碘的升华 |
B | 以曾青涂铁,铁赤色如铜 | 置换反应 |
C | 煮豆燃豆萁 | 化学能转化为热能、光能 |
D | 雷雨肥庄稼 | 自然固氮 |
A.AB.BC.CD.D