题目内容
【题目】在一定温度下,将0.2mol的碘化氢充入1L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.08mol/L.
(1)求该反应的平衡常数。
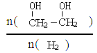
(2)在上述温度下,该容器中若充入碘化氢0.4mol,求达到 平衡时碘化氢的转化率和氢气的物质的量浓度。2HI(g) ![]() H2(g) + I2(g)
H2(g) + I2(g)
【答案】(1)k= 4;(2)碘化氢转化率=80% ,氢气的浓度0.16mol/L。
【解析】
试题分析:(1) 2HI(g) ![]() H2(g)+I2(g)
H2(g)+I2(g)
起始(mol/L): 0.2 0 0
变化: 2a a a
平衡: 0.2-2a a a
根据信息,a=0.08mol/L,化学平衡常数:达到平衡后,生成物浓度幂之积与反应物浓度幂之积的比值,K=c(H2)×c(I2)/c2(HI)=0.08×0.08/(0.2-2×0.08)2=4;
(2)温度不变,化学平衡常数不变,K= c(H2)×c(I2)/c2(HI)=a×a/(0.4-2a)2=4,解得:a=0.16mol/L,则氢气的浓度为0.16mol/L,碘化氢转化率为2a/0.4×100%=2×0.16/0.4×100%=80%。

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案
相关题目