题目内容
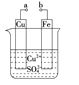
【题目】短周期元素 W、X、Y、Z 在元素周期表中的位置如右图所示。其中 Z 的单质是一种重要半导体材料,广泛应用于电子工业的各个领域。
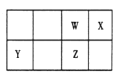
(1)W 在元素周期表中的位置是____________。
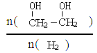
(2)W、X、氢元素形成的三原子分子的电子式____________。
(3)下列选项中,能证明元素非金属性X强于W的是____________。
A.相对原子质量:X>W | B.最低化合价:X>W |
C.最简单氢化物的稳定性:X>W | D.最高价氧化物的水化物酸性:X>W |
(4)元素周期表中与 Z 同周期的某金属元素形成的单质 A,可发生如下图所示的转化:
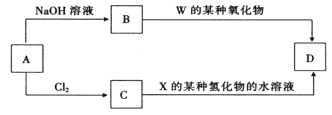
其中化合物D是一种白色沉淀,则 B 中溶质的化学式为____________;
B与 C也可直接转化生成 D 写出对应的离子方程式为____________。
【答案】(1)第二周期第IVA 族(2)![]() (3)C D(4)NaAlO2Al3++3AlO2-+6H2O=Al(OH) 3↓
(3)C D(4)NaAlO2Al3++3AlO2-+6H2O=Al(OH) 3↓
【解析】试题分析:短周期元素W、X、Y、Z,Z元素的单质是一种重要的半导体材料,则Z为Si元素;由元素在周期表中的位置可知,Y为镁元素、W为碳元素、X为氮元素;
(1)W为碳,C在元素周期表中的位置是:第二周期第ⅣA族;
(2)W、X、氢元素形成的三原子分子为HCN,分子中C、N之间形成3对共用电子对,H原子与C原子之间形成1等于共用电子对;
(3)元素的非金属性越强,对应的气态氢化物越稳定,其最高价氧化物的水化物酸性越强,与原子序数及化合价无关,故答案为CD;
(4)金属铝在第三周期,能与氢氧化钠反应生成偏铝酸钠,能与氯气该反应生成氯化铝,偏铝酸钠与二氧化碳反应生成氢氧化铝白色沉淀,氯化铝与一水合氨反应生成氢氧化铝沉淀,故B中的溶质是偏铝酸钠,化学式为NaAlO2,氯化铝与一水和氨反应生成氢氧化铝沉淀,离子反应方程式为Al3++3NH3H2O=Al(OH)3↓+3NH4+。

 阅读快车系列答案
阅读快车系列答案