题目内容
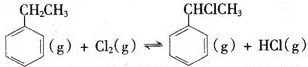
【题目】乙苯是一种用途广泛的有机原料,可制备多种化工产品。
(一)制备苯乙烯(原理如反应I所示):

(1)工业上,在恒压设备中进行反应I时,常在乙苯蒸气中通入一定量的水蒸气。用化学平衡理论解释通入水蒸气的原因为 。
(2)从体系自由能变化的角度分析,反应I在____(填“高温”或“低温”)下有利于其自发进行。
(二)制备α-氯乙基苯(原理如反应II所示):

(3)T℃时,向10 L恒容密闭容器中充入2mol乙苯(g)和2 mol Cl2(g)发生反应Ⅱ,5 min时达到平衡,乙苯和Cl2、α-氯乙基苯和HC1的物质的量浓度(c)随时间(t)变化的曲线如图l所示:


①0—5 min内,以HC1表示的该反应速率v(HCl)=____ 。
②T℃时,该反应的平衡常数K=____ 。
③6 min时,改变的外界条件为________。
④10 min时,保持其他条件不变,再向容器中充入1mol乙苯、1 mol Cl2、1 mol α-氯乙基苯 和l mol HCl,12 min时达到新平衡。在图2中画出10-12 min,Cl2和HCl的浓度变化曲线(曲线上标明Cl2和HCl);0—5 min和0—12 min时间段,Cl2的转化率分别用α1、α2 表示,则αl α2(填“>”、“<”或“=”)。
【答案】(1)该反应正向为气体分子数增大的反应,入水蒸气需增大容器容积,减小体系压强,平衡正向移动,增大反应物的转化率。(2)高温(3)①0.032 mol·L-1·min-1 ;②16; ③升高温度
④ ;>
;>
【解析】
试题分析:(1)正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动;故答案为:该反应正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率;
(2)反应I的△S>0,根据ΔG=ΔH-TΔS,该反应在高温下有利于其自发进行,故答案为:高温
(3) ①0—5 min内,以HC1表示的该反应速率v(HCl)=![]() = 0.032 mol·L-1·min-1,故答案为:0.032 mol·L-1·min-1;
= 0.032 mol·L-1·min-1,故答案为:0.032 mol·L-1·min-1;
②T℃时,该反应的平衡常数K=c(α-氯乙基苯)c(HC1)/c(Cl2)c(乙苯)=![]() =16,故答案为:16;
=16,故答案为:16;
③6 min时,平衡向右移动,反应物核外生成物的浓度没有发生突变,根据该反应正反应为吸热反应,因此改变的外界条件为升高温度,故答案为:升高温度;
④10 min时,保持其他条件不变,再向容器中充入1mol乙苯、1 mol Cl2、1 mol α-氯乙基苯 和l mol HCl,12 min时,四种物质的浓度分别变为c(α-氯乙基苯)=0.28mol/L,c(HC1) =0.28mol/L,c(Cl2) =0.12mol/L,c(乙苯) =0.12mol/L,假设反应的C12的浓度为x
开始(mol/L)0.12 0.12 0.28 028
反应 x x x x
平衡 0.12-x 0.12-x 0.28+x 0.28+x
则![]() =16,解得x=0.04,10-12 min,Cl2和HCl的浓度变化曲线为
=16,解得x=0.04,10-12 min,Cl2和HCl的浓度变化曲线为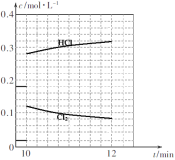 ,0—5 min,Cl2的转化率α1=
,0—5 min,Cl2的转化率α1=![]() ×100%=80%,0—12 min时间段,Cl2的转化率α2=
×100%=80%,0—12 min时间段,Cl2的转化率α2=![]() ×100%=73%,则αl>α2,故答案为:
×100%=73%,则αl>α2,故答案为: ;>。
;>。