题目内容
16.根据原子结构及元素周期律的知识,下列推断正确的是( )| A. | 35173517Cl与37173717Cl得电子能力相同 | |
| B. | 元素周期表第ⅠA族元素都是金属元素 | |
| C. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
分析 A.互为同位素原子的化学性质几乎完全相同;
B.第ⅠA族元素氢是非金属;
C.电子层结构相同,核电荷数越大离子半径越小;
D.同主族元素最高价含氧酸自上而下酸性减弱;
解答 解:A.3517Cl与3717Cl互为同位素,化学性质几乎完全相同,电子能力相同,故A正确;
B.第ⅠA族元素氢是非金属,故B错误;
C.S2-、Cl-、Ca2+、K+电子层结构相同,核电荷数越大离子半径越小,故离子半径S2->Cl->K+>Ca2+,故C错误;
D.同主族元素最高价含氧酸自上而下酸性减弱,不是最高价含氧酸不一定,如HClO为弱酸、HBrO4为强酸,故D错误;
故选A.
点评 本题考查同主族元素性质递变规律、微粒半径比较、原子结构与性质关系等,难度不大,注意对基础知识的理解掌握.

练习册系列答案
相关题目
7.下列各项表达式正确的是( )
| A. | N2的电子式: | B. | F-的结构示意图: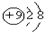 | ||
| C. | 二氧化碳分子的结构式为 O-C-O | D. | NaCl的电子式: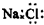 |
4.下列变化过程,属于放热过程的是( )
①液态水变成水蒸气 ②酸碱中和反应 ③浓H2SO4稀释 ④固体氢氧化钠溶于水 ⑤H2在Cl2中燃烧 ⑥NH4Cl晶体与Ba(OH)2•8H2O混合搅拌.
①液态水变成水蒸气 ②酸碱中和反应 ③浓H2SO4稀释 ④固体氢氧化钠溶于水 ⑤H2在Cl2中燃烧 ⑥NH4Cl晶体与Ba(OH)2•8H2O混合搅拌.
| A. | ②③④⑥ | B. | ①②⑥ | C. | ②③④⑤ | D. | ①③⑤ |
11.下列变化中,不需要破坏化学键的是( )
| A. | 氯化氢溶于水 | B. | 氯化铵受热分解 | C. | 干冰升华 | D. | 氯化钠熔化 |
1.X、Y代表两种非金属元素,下列能说明非金属性X比Y强的是( )
| A. | 还原性X-强于Y2- | |
| B. | X的含氧酸的酸性比Y的含氧酸的酸性强 | |
| C. | X的单质X2能将Y的阴离子Y2-氧化,并发生置换反应 | |
| D. | X的氢化物比Y的氢化物沸点高 |
5.下列变化中,原物质分子内共价键被破坏,同时有离子键生成的是( )
| A. | 二氧化硅与氢氧化钠溶液 | B. | 氯化氢溶于水 | ||
| C. | 氯化氢与氨反应 | D. | 锌与稀硫酸反应 |
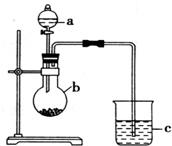 “元素的最高价氧化物对应的水化物酸性越强非金属性越强”某同学欲运用这一观点来验证硫和碳两元素的得电子的能力强弱,设计实验如图所示,请回答:
“元素的最高价氧化物对应的水化物酸性越强非金属性越强”某同学欲运用这一观点来验证硫和碳两元素的得电子的能力强弱,设计实验如图所示,请回答: