题目内容
6.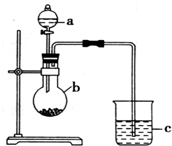 “元素的最高价氧化物对应的水化物酸性越强非金属性越强”某同学欲运用这一观点来验证硫和碳两元素的得电子的能力强弱,设计实验如图所示,请回答:
“元素的最高价氧化物对应的水化物酸性越强非金属性越强”某同学欲运用这一观点来验证硫和碳两元素的得电子的能力强弱,设计实验如图所示,请回答:(1)仪器a的名称分液漏斗
(2)a、b、c中盛放的药品或试剂分别是(均填序号):
a① b⑤ c⑦
①稀硫酸 ②亚硫酸③盐酸④碳酸钙⑤碳酸钠⑥氢氧化钠溶液 ⑦澄清的石灰
(3)b中发生反应的离子方程式为2H++CO32-=CO2↑+H2O
(4)c中观察到的现象是澄清的石灰水变浑浊,由此得出的结论是硫酸的酸性强于碳酸,所以硫元素的非金属性强于碳元素,硫的电子的能力强于碳..
分析 (1)熟悉常见仪器,说出其名称;
(2)通过比较C、S元素的最高价氧化物对应的水化物的酸碳酸和硫酸的酸性强弱来证明硫与碳的非金属性的强弱,依据强酸制备弱酸的规律选择合适的试剂;
(3)碳酸钠与稀硫酸反应生成硫酸钠和水、二氧化碳;
(4)硫酸酸性强于碳酸,反应生成二氧化碳,二氧化碳与澄清石灰水反应生成碳酸钙,据此解答.
解答 解:(1)仪器a的名称为分液漏斗,故答案为:分液漏斗;
(2)比较C、S元素的最高价氧化物对应的水化物的酸碳酸和硫酸的酸性强弱来证明硫与碳的非金属性的强弱所需进行的反应是硫酸和碳酸盐的反应,强酸可以制得弱酸,所以可以在a中放稀硫酸,在b中放碳酸钠,c中放澄清的石灰水;
故答案为:①;⑤;⑦;
(3)碳酸钠与稀硫酸反应生成硫酸钠和水、二氧化碳,反应的离子方程式:2H++CO32-=CO2↑+H2O,故答案为:2H++CO32-=CO2↑+H2O;
(4)硫酸酸性强于碳酸,反应生成二氧化碳,二氧化碳与澄清石灰水反应生成碳酸钙,所以产生的现象为:澄清石灰水变浑浊;
故答案为:澄清的石灰水变浑浊; 硫酸的酸性强于碳酸,所以硫元素的非金属性强于碳元素,硫的电子的能力强于碳.
点评 本题考查了实验设计,熟悉元素非金属性判断依据、强酸制备弱酸的规律即可解答,题目难度不大.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
2.下列关于常见有机化合物说法正确的是( )
| A. | 甲烷、乙烯和苯都可以从化石燃料中提取,都能使溴水因发生化学反应而褪色 | |
| B. | 乙烯和苯分子中因都存在C═C,因为都能发生加成反应和氧化反应 | |
| C. | 酸性KMnO4溶液既可鉴别乙烷与乙烯,又可除去乙烷中的乙烯而得到纯净的乙烷 | |
| D. | 只用一种试剂就可以鉴别乙醇、乙酸、四氯化碳、苯四种液体 |
17.下列说法正确的是( )
| A. | 化学反应都是吸热反应 | |
| B. | 化学反应都是放热反应 | |
| C. | 物质发生化学反应都伴随着能量变化 | |
| D. | 有能量变化的物质变化都是化学变化 |
14.发现元素周期律并绘制出第一张元素周期表的科学家是( )
| A. | 道尔顿 | B. | 门捷列夫 | C. | 卢瑟福 | D. | 迈尔 |
1.已知下列反应的焓变:
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=-870.3KJ•mol-1
(2)C(s)+O2(g)=CO2(g)△H2=-393.5KJ•mol-1
(3)H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H3=-285.8KJ•mol-1
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的焓变为( )
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=-870.3KJ•mol-1
(2)C(s)+O2(g)=CO2(g)△H2=-393.5KJ•mol-1
(3)H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H3=-285.8KJ•mol-1
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的焓变为( )
| A. | -870.3KJ•mol-1 | B. | -571.6KJ•mol-1 | C. | +787.0KJ•mol-1 | D. | -488.3KJ•mol-1 |
11.由羟基分别跟下列基团相互结合所构成的化合物中,属于醇类的是( )
| A. | 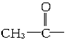 | B. | C6H5- | C. | 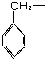 | D. | 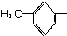 |
18.下列有关物质的分类或归类不正确的是( )
①混合物:碘酒、盐酸、牛奶、水银
②化合物:CaCl2、烧碱、硫酸铜晶体、HD
③电解质:明矾、醋酸、硫酸钡
④纯净物:干冰、冰水混合物、浓硫酸
⑤同位素:${\;}_{6}^{12}$C、${\;}_{6}^{13}$C、${\;}_{6}^{14}$C.
①混合物:碘酒、盐酸、牛奶、水银
②化合物:CaCl2、烧碱、硫酸铜晶体、HD
③电解质:明矾、醋酸、硫酸钡
④纯净物:干冰、冰水混合物、浓硫酸
⑤同位素:${\;}_{6}^{12}$C、${\;}_{6}^{13}$C、${\;}_{6}^{14}$C.
| A. | ①②③④ | B. | ①②④ | C. | ①③④⑤ | D. | ②④⑤ |
15.下列反应中,生成物所贮的化学能比反应物所贮化学能要多的是( )
| A. | CaO+H2O=Ca(0H)2 | B. | C+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO | ||
| C. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | D. | 2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2 |
16.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 | |
| B. | 元素周期表第ⅠA族元素都是金属元素 | |
| C. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |