题目内容
8.下列6种固态物质:①P4 ②SiO2 ③NH4Cl ④NaF ⑤CO2(干冰)⑥金刚石,回答下列问题:(1)熔化时不需要破坏化学键的化合物是⑤(填序号,下同)
(2)熔化时需要破坏共价键的单质是⑥
(3)含有共价键的离子化合物是③.
分析 先判断晶体类型,再判断化学键类型;
①P4属分子晶体,只含共价键键;
②SiO2属原子晶体,只含共价键;
③NH4Cl属离子晶体,既含共价键和离子键;
④NaF属离子晶体,含离子键;
⑤CO2属于分子晶体,只存在共价键,分子间有分子间作用力;
⑥金刚石属于原子晶体,只存在共价键.
解答 先判断晶体类型,再判断化学键类型;
①P4属分子晶体,只含共价键键;
②SiO2属原子晶体,只含共价键;
③NH4Cl属离子晶体,既含共价键和离子键;
④NaF属离子晶体,含离子键;
⑤CO2属于分子晶体,只存在共价键,分子间有分子间作用力;
⑥金刚石属于原子晶体,只存在共价键.
(1)熔化时不需要破坏化学键的化合物是分子晶体,故选⑤;
(2)熔化时需要破坏共价键的单质是原子晶体,故选⑥;
(3)既含共价键又含离子键的是NH4Cl,故选③.
故答案为:⑤,⑥,③.
点评 本题考查的知识点较多,侧重考查学生对离子键、共价键,离子化合物、共价化合物的书写的辨别能力,题目难度不大.

练习册系列答案
相关题目
18.下列有关物质的分类或归类不正确的是( )
①混合物:碘酒、盐酸、牛奶、水银
②化合物:CaCl2、烧碱、硫酸铜晶体、HD
③电解质:明矾、醋酸、硫酸钡
④纯净物:干冰、冰水混合物、浓硫酸
⑤同位素:${\;}_{6}^{12}$C、${\;}_{6}^{13}$C、${\;}_{6}^{14}$C.
①混合物:碘酒、盐酸、牛奶、水银
②化合物:CaCl2、烧碱、硫酸铜晶体、HD
③电解质:明矾、醋酸、硫酸钡
④纯净物:干冰、冰水混合物、浓硫酸
⑤同位素:${\;}_{6}^{12}$C、${\;}_{6}^{13}$C、${\;}_{6}^{14}$C.
| A. | ①②③④ | B. | ①②④ | C. | ①③④⑤ | D. | ②④⑤ |
19.下列反应中不属于可逆反应的是( )
| A. | Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O | |
| B. | N2+3H2$?_{催化剂}^{高温、高压}$2NH3 | |
| C. | Cl2+H2O?HCl+HClO | |
| D. | 2NO2?N2O4 |
16.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 | |
| B. | 元素周期表第ⅠA族元素都是金属元素 | |
| C. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
20.已知R2+核外有X个电子,相对原子质量为M,这种元素所含的中子数是( )
| A. | M-X-2 | B. | M-X+2 | C. | X-2 | D. | M-2 |
17.下列关于甲烷的叙述中不正确的是( )
| A. | 甲烷分子的空间结构为正四面体,4条C-H键完全相同 | |
| B. | 甲烷可使澄清石灰水变浑浊 | |
| C. | 甲烷不能使酸性高锰酸钾溶液褪色 | |
| D. | 甲烷与氯气在光照下可以发生取代反应 |
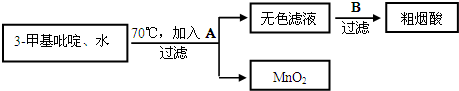
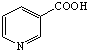 )俗称烟酸,微溶于水.可作血管扩张类药物.完成下列填空:
)俗称烟酸,微溶于水.可作血管扩张类药物.完成下列填空: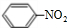 .试剂浓硝酸、浓硫酸.
.试剂浓硝酸、浓硫酸.