题目内容
7.下列各项表达式正确的是( )| A. | N2的电子式: | B. | F-的结构示意图: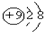 | ||
| C. | 二氧化碳分子的结构式为 O-C-O | D. | NaCl的电子式: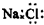 |
分析 A.氮气分子的电子式中,氮原子最外层达到8电子稳定结构,漏掉了氮原子的孤电子对;
B.氟离子的核电荷数为9,核外电子总数为10;
C.二氧化碳为直线型结构,分子中存在两个碳氧双键;
D.氯化钠为离子化合物,电子式中没有标出阴阳离子所带电荷.
解答 解:A.氮气分子中存在氮氮三键,氮气正确的电子式为 ,故A错误;
,故A错误;
B.氟离子的核电荷数为9,最外层达到8电子稳定结构,氟离子的结构示意图为: ,故B正确;
,故B正确;
C.二氧化碳分子中存在两个碳氧双键,其正确的结构式为O=C=O,故C错误;
D.氯化钠为离子化合物,阴阳离子需要标出所带电荷,氯化钠正确的电子式为: ,故D错误;故选B.
,故D错误;故选B.
点评 本题考查了电子式、结构式、离子结构示意图等化学用语的判断,题目难度中等,熟练掌握常见化学用语的概念及书写原则为解答关键,试题培养了学生规范答题的能力.

练习册系列答案
相关题目
17.下列说法正确的是( )
| A. | 化学反应都是吸热反应 | |
| B. | 化学反应都是放热反应 | |
| C. | 物质发生化学反应都伴随着能量变化 | |
| D. | 有能量变化的物质变化都是化学变化 |
18.下列有关物质的分类或归类不正确的是( )
①混合物:碘酒、盐酸、牛奶、水银
②化合物:CaCl2、烧碱、硫酸铜晶体、HD
③电解质:明矾、醋酸、硫酸钡
④纯净物:干冰、冰水混合物、浓硫酸
⑤同位素:${\;}_{6}^{12}$C、${\;}_{6}^{13}$C、${\;}_{6}^{14}$C.
①混合物:碘酒、盐酸、牛奶、水银
②化合物:CaCl2、烧碱、硫酸铜晶体、HD
③电解质:明矾、醋酸、硫酸钡
④纯净物:干冰、冰水混合物、浓硫酸
⑤同位素:${\;}_{6}^{12}$C、${\;}_{6}^{13}$C、${\;}_{6}^{14}$C.
| A. | ①②③④ | B. | ①②④ | C. | ①③④⑤ | D. | ②④⑤ |
15.下列反应中,生成物所贮的化学能比反应物所贮化学能要多的是( )
| A. | CaO+H2O=Ca(0H)2 | B. | C+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO | ||
| C. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | D. | 2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2 |
2.下列说法正确的是( )
| A. | 在实验室中将工业酒精转化为无水酒精的方法是:加入过量的生石灰后分液 | |
| B. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 | |
| C. | 用重结晶法提纯NaCl和KNO3混合物中的KNO3 | |
| D. | 用湿润的pH试纸测定溶液的pH,测定结果偏小,该溶液一定呈酸性 |
19.下列反应中不属于可逆反应的是( )
| A. | Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O | |
| B. | N2+3H2$?_{催化剂}^{高温、高压}$2NH3 | |
| C. | Cl2+H2O?HCl+HClO | |
| D. | 2NO2?N2O4 |
16.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 | |
| B. | 元素周期表第ⅠA族元素都是金属元素 | |
| C. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
17.下列关于甲烷的叙述中不正确的是( )
| A. | 甲烷分子的空间结构为正四面体,4条C-H键完全相同 | |
| B. | 甲烷可使澄清石灰水变浑浊 | |
| C. | 甲烷不能使酸性高锰酸钾溶液褪色 | |
| D. | 甲烷与氯气在光照下可以发生取代反应 |