题目内容
5.下列变化中,原物质分子内共价键被破坏,同时有离子键生成的是( )| A. | 二氧化硅与氢氧化钠溶液 | B. | 氯化氢溶于水 | ||
| C. | 氯化氢与氨反应 | D. | 锌与稀硫酸反应 |
分析 非金属原子之间形成的键大多是共价键,金属和非金属原子之间形成的化学键大多是离子键.
解答 解:A、二氧化硅是原子晶体,而不是分子,同时破坏了离子键,也形成离子键,故A错误;
B、氯化氢溶于水只有共价键的断裂,故B错误;
C、氯化氢与氨气反应生成氯化铵固体时,破坏了氯化氢中的共价键,同时生成了铵根和氯离子之间的离子键,故C正确;
D、锌与稀硫酸反应没有共价键的破坏,故D错误.
故选C.
点评 要熟记共价键和离子键的概念以及区别,可以根据所学知识进行回答,难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
15.下列反应中,生成物所贮的化学能比反应物所贮化学能要多的是( )
| A. | CaO+H2O=Ca(0H)2 | B. | C+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO | ||
| C. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | D. | 2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2 |
16.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 | |
| B. | 元素周期表第ⅠA族元素都是金属元素 | |
| C. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
20.已知R2+核外有X个电子,相对原子质量为M,这种元素所含的中子数是( )
| A. | M-X-2 | B. | M-X+2 | C. | X-2 | D. | M-2 |
10.有一种有机化合物,其结构简式如图: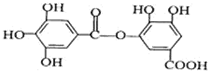 ,下列有关它的性质的叙述中,正确的是( )
,下列有关它的性质的叙述中,正确的是( )
 ,下列有关它的性质的叙述中,正确的是( )
,下列有关它的性质的叙述中,正确的是( )| A. | 有弱酸性,1 mol该有机物与溴水反应,最多能消耗4mol Br2 | |
| B. | 在一定条件下,1mol该物质最多能与6mol NaOH完全反应 | |
| C. | 在Ni催化下,1 mol 该物质可以和7mol H2发生加成反应 | |
| D. | 它能发生水解反应,水解后只能生成两种产物 |
17.下列关于甲烷的叙述中不正确的是( )
| A. | 甲烷分子的空间结构为正四面体,4条C-H键完全相同 | |
| B. | 甲烷可使澄清石灰水变浑浊 | |
| C. | 甲烷不能使酸性高锰酸钾溶液褪色 | |
| D. | 甲烷与氯气在光照下可以发生取代反应 |
20.下列叙述正确的是( )
| A. | ${\;}_{8}^{16}$O和${\;}_{8}^{18}$O互称同素异形体 | B. | 丙烷和异丁烷互称同系物 | ||
| C. | 金刚石和石墨互称同位素 | D. |  和 和 互称同分异构体 互称同分异构体 |