题目内容
6.某短周期元素X的气态氢化物化学式为HnX.在标准状况下,8.5g HnX气体的体积是5.6L. 17g HnX气体与200ml 5mol/L的NaOH溶液恰好完全反应.(1)求X的相对原子质量.
(2)写出HnX的化学式,并用电子式表示它的形成过程.
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算气体的物质的量,再根据M=$\frac{m}{n}$计算其摩尔质量,依据酸碱中和原理判断n,然后计算X的相对原子质量即可;
(2)硫化氢为共价化合物,据此书写即可.
解答 解:(1)在标准状况下,8.5gHnX气体的体积是5.6L,其物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,其摩尔质量为$\frac{8.5g}{0.25mol}$=34g/mol,故HnX的式量34,17gHnX物质的量为0.5mol,200ml 5mol/L的NaOH物质的量为0.2L×5mol/L=1mol,故此酸为二元酸,即n=2,那么X的相对原子质量=34-2=32,即为S元素,
答:相对原子质量为32;
(2)X为S,n=2,那么HnX为H2S,硫化氢为共价化合物,分子中存在两个H-S键,用电子式表示其形成过程为: ,
,
答:H2S; .
.
点评 本题主要考查的是元素相对原子质量的计算以及用电子式表示共价化合物的形成过程,涉及物质的量的有关计算、中和反应,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 | |
| B. | 元素周期表第ⅠA族元素都是金属元素 | |
| C. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
17.下列关于甲烷的叙述中不正确的是( )
| A. | 甲烷分子的空间结构为正四面体,4条C-H键完全相同 | |
| B. | 甲烷可使澄清石灰水变浑浊 | |
| C. | 甲烷不能使酸性高锰酸钾溶液褪色 | |
| D. | 甲烷与氯气在光照下可以发生取代反应 |
11.某化学兴趣小组对某“氢铵”化肥进行了专项研究:
(1)预测:根据已有知识和“氢铵”的名称,该小组预测该“氢铵”是碳酸或亚硫酸或硫酸的铵盐.
(2)实验和探究:
①NH4+的验证:取少量固体药品于试管中,然后滴加NaOH浓溶液,加热试管,将湿润的红色石蕊试纸置于试管口部,若红色石蕊试纸变蓝,则证明含NH4+.
②阴离子的探究:取少量固体药品于试管中,然后向试管中滴加稀盐酸,固体全部溶解,将产生的气体通入图1装置.观察到的现象是溴水无明显变化,澄清石灰水变浑浊.再向滴加稀盐酸反应后的试管中加Ba(OH)2溶液,无明显现象.

初步结论:“氢铵”是碳酸的铵盐.
③思考:上述实验步骤②加入Ba(OH)2溶液的目的是检验是否存在SO42-.根据初步实验结论,提出假设:
假设1:氢铵成分是NH4HCO3 假设2:氢铵成分是(NH4)2CO3
假设3:氢铵成分是(NH4)2CO3和NH4HCO3的混合物.
④根据上述假设,设计实验得出结论.限选试剂和仪器有:CaCl2溶液、品红溶液、Ba(NO3)2溶液、1.0mol/L盐酸、1.0mol•L-1 NaOH溶液、饱和澄清石灰水、BaCl2溶液、Ba(OH)2溶液、试管、胶头滴管
(3)延伸探究:
①根据氢铵成分,设计小组根据下面实验装置来制备NH4HCO3是否合理否(填“是”或“否”)
②该实验小组设计了以下实验方案测定氢铵中的含氮量,请你阅读后进行评价:准确称取一定质量的样品,放入图2方案的烧瓶中,滴加过量NaOH浓溶液,充分微热,按如图3装置,通过实验测定烧杯增加的质量(忽略漏斗中附着溶液的质量).然后进行计算,可得化肥的含氮量.请你评价上述方案是否合理.若合理只需要说明结论;若不合理,请简要说明原因,并指出修改方案(若要添加仪器、药品,请说明添加的位置、名称)
不合理,装置中没有干燥装置,稀硫酸吸收了较多水蒸气,误差太大;在烧杯前加一个装有碱石灰的干燥管.
(1)预测:根据已有知识和“氢铵”的名称,该小组预测该“氢铵”是碳酸或亚硫酸或硫酸的铵盐.
(2)实验和探究:
①NH4+的验证:取少量固体药品于试管中,然后滴加NaOH浓溶液,加热试管,将湿润的红色石蕊试纸置于试管口部,若红色石蕊试纸变蓝,则证明含NH4+.
②阴离子的探究:取少量固体药品于试管中,然后向试管中滴加稀盐酸,固体全部溶解,将产生的气体通入图1装置.观察到的现象是溴水无明显变化,澄清石灰水变浑浊.再向滴加稀盐酸反应后的试管中加Ba(OH)2溶液,无明显现象.

初步结论:“氢铵”是碳酸的铵盐.
③思考:上述实验步骤②加入Ba(OH)2溶液的目的是检验是否存在SO42-.根据初步实验结论,提出假设:
假设1:氢铵成分是NH4HCO3 假设2:氢铵成分是(NH4)2CO3
假设3:氢铵成分是(NH4)2CO3和NH4HCO3的混合物.
④根据上述假设,设计实验得出结论.限选试剂和仪器有:CaCl2溶液、品红溶液、Ba(NO3)2溶液、1.0mol/L盐酸、1.0mol•L-1 NaOH溶液、饱和澄清石灰水、BaCl2溶液、Ba(OH)2溶液、试管、胶头滴管
| 实验步骤 | 预期现象及结论 |
| 步骤1:取适量“氢铵”配制成溶液,取1~2ml试液于一支洁净的试管中,加足量BaCl2溶液,充分振荡. | ①若出现白色沉淀,证明氢铵中含有(NH4)2CO3; ②若没有明显现象可能含有NH4HCO3 |
| 步骤2:静置,取上层清液少许于另一试管中, 继续滴加滴加适量Ba(OH)2溶液,振荡观察现象. | 若出现白色沉淀,证明氢铵中含有NH4HCO3结合步骤1②,则假设1成立; 结合步骤1①,则假设3成立; 仅在步骤1中产生白色沉淀,则假设2成立;. |
①根据氢铵成分,设计小组根据下面实验装置来制备NH4HCO3是否合理否(填“是”或“否”)
②该实验小组设计了以下实验方案测定氢铵中的含氮量,请你阅读后进行评价:准确称取一定质量的样品,放入图2方案的烧瓶中,滴加过量NaOH浓溶液,充分微热,按如图3装置,通过实验测定烧杯增加的质量(忽略漏斗中附着溶液的质量).然后进行计算,可得化肥的含氮量.请你评价上述方案是否合理.若合理只需要说明结论;若不合理,请简要说明原因,并指出修改方案(若要添加仪器、药品,请说明添加的位置、名称)
不合理,装置中没有干燥装置,稀硫酸吸收了较多水蒸气,误差太大;在烧杯前加一个装有碱石灰的干燥管.
20.下列叙述正确的是( )
| A. | ${\;}_{8}^{16}$O和${\;}_{8}^{18}$O互称同素异形体 | B. | 丙烷和异丁烷互称同系物 | ||
| C. | 金刚石和石墨互称同位素 | D. |  和 和 互称同分异构体 互称同分异构体 |
1.一定条件下合成乙烯:6H2(g)+2CO2(g)$\stackrel{催化剂}{?}$CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )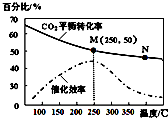

| A. | 生成乙烯的速率:v(M)有可能小于v(N) | |
| B. | 平衡常数:KM>KN | |
| C. | 当温度高于250℃,升高温度,平衡向逆反应方向移动,从而使催化剂的催化效率降低 | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7% |
 互为同系物且一氯代物只有两种的物质的结构简式:
互为同系物且一氯代物只有两种的物质的结构简式: 或
或 .
.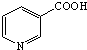 )俗称烟酸,微溶于水.可作血管扩张类药物.完成下列填空:
)俗称烟酸,微溶于水.可作血管扩张类药物.完成下列填空: .试剂浓硝酸、浓硫酸.
.试剂浓硝酸、浓硫酸.