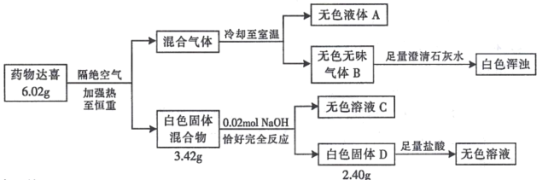
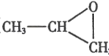
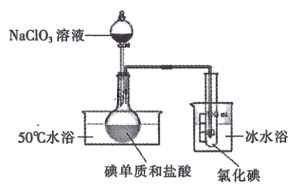
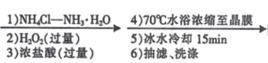
题目内容
【题目】下列反应中,氧化剂与还原剂物质的量的关系不是1∶2的是
A.O3+2KI+H2O===2KOH+I2+O2
B.3NO2+H2O===2HNO3+NO
C.3S+6NaOH===Na2SO3+2Na2S+3H2O
D.4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
【答案】C
【解析】
氧化还原反应中化合价降低得电子的物质为氧化剂,化合价升高失电子的是还原剂,结合方程式判断。
A.O3+2KI+H2O═2KOH+I2+O2,反应中O3为氧化剂,KI为还原剂,则氧化剂与还原剂物质的量之比为1:2,故A不选;
B.3NO2+H2O═2HNO3+NO,反应中1molNO2得电子为氧化剂,2molNO2失电子为还原剂,则氧化剂与还原剂物质的量之比为1:2,故B不选;
C.3S+6NaOH═Na2SO3+2Na2S+3H2O反应中2molS得电子为氧化剂,1molS失电子为还原剂,则氧化剂与还原剂物质的量之比为2:1,故C选;
D.4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O,反应中1molMnO2得电子为氧化剂,2molHCl失电子为还原剂,则氧化剂与还原剂物质的量之比为1:2,故D不选;
MnCl2+Cl2↑+2H2O,反应中1molMnO2得电子为氧化剂,2molHCl失电子为还原剂,则氧化剂与还原剂物质的量之比为1:2,故D不选;
答案选C。

练习册系列答案
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目