题目内容
【题目】某兴趣小组利用Cl-取代[Co(NH3)6]3+离子中的NH3方法,制备配合物X:[Co(NH3)5Cl]Cl2。实验过程如下:
CoCl2﹒6H2O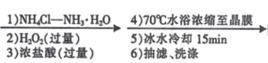 [Co(NH3)5Cl]Cl2晶体
[Co(NH3)5Cl]Cl2晶体
已知:
a.配合物X 能溶于水,且溶解度随温度升高而增大。
b.[Co( NH3)5Cl]2+离子较稳定,但加碱再煮沸可促进其解离:[Co(NH3)5Cl]2+![]() Co3++5NH3+Cl。
Co3++5NH3+Cl。
c.H2O2参与反应时,明显放热。
请回答:
(1)制备配合物X的总反应方程式为___________。
(2)“1) NH4Cl-NH3H2O”时,如果不加NH4Cl固体,对制备过程的不利影响是____。
(3)“2)H2O2”加H2O2 时应选择 _________(填序号)。
A.冷水浴 B.温水浴( ≈60°C)
C.沸水浴 D.酒精灯直接加热
(4)本实验条件下,下列物质均可将 Co(II)氧化为 Co(III)。其中可替代“2)H2O2”的是_____________(填序号)。
A.O2 B.KMnO4 溶液 C.Cl2 D.HNO3
(5)实验小组用以下思路验证配合物 X 的组成:取一定量 X 加入过量浓 NaOH 溶液,煮沸,将生成的NH3 通入一定量的稀硫酸中,再用NaOH 标准溶液滴定剩余 H2SO4 。从以下涉及碱式滴定管的操作中,选择正确操作并排序(润洗只操作一次即可):

检漏→水洗→加标准液,润洗内壁→___________→_________→_________→_________→……
a.从上口倒出润洗液
b.保持滴定管夹水平,平视滴定管刻度读数
c.装标准溶液,调液面,静置半分钟
d.滴定
e.取下滴定管,竖直,平视滴定管刻度读数
f.从下口放出润洗液
(6)下列关于实验过程的叙述,正确的是_____________(填序号)。
A.“4)70℃”水浴加热,有利于获得颗粒较大的晶体
B.抽滤后,应该用热水洗涤晶体
C.可用 AgNO3和稀HNO3 检验配合物X 是否已经洗净
D.抽滤结束,可先打开活塞K,再关掉抽气泵
【答案】2 CoCl2+H2O2+ 10NH3 +2HCl=2[ Co(NH3) 5Cl] Cl2+2H2O 形成Co(OH)2沉淀, 影响配合物的生成 A AC f c e d AD
【解析】
CoCl2﹒6H2O先和NH4Cl以及NH3﹒H2O混合,然后被H2O2氧化,+2价钴被氧化为+3价,+3价的Co3+和NH3以及浓盐酸提供的Cl-形成配合物,经蒸发浓缩、冷却结晶、抽滤、洗涤、干燥得到最终的产品[Co(NH3)5Cl]Cl2。
(1)制备配合物X的原料是CoCl2﹒6H2O、NH4Cl、NH3﹒H2O、H2O2、浓盐酸,在反应中,2价钴被H2O2氧化为+3价,+3价的Co3+和NH3以及Cl-形成配合物[Co(NH3)5Cl]Cl2,总反应方程式为2 CoCl2+H2O2+ 10NH3 +2HCl=2[ Co(NH3) 5Cl] Cl2+2H2O。
(2)在“1) NH4Cl-NH3H2O”步骤中,NH4Cl可以抑制NH3﹒H2O的电离,如果不加NH4Cl固体,Co2+会和氨水形成Co(OH)2沉淀,影响配合物的生成。
(3)由于H2O2参与反应时,明显放热,所以“2)H2O2”加H2O2 后应该在冰水浴中发生反应,故选A。
(4)本实验是用H2O2将Co(II)氧化为Co(III),H2O2的还原产物是水,不会引入新杂质,若选择可以替代H2O2的氧化剂,也不能引入新杂质。可以选择O2和Cl2,O2的还原产物是水,Cl2的还原产物是Cl-,水和Cl-在本实验中均不是杂质。KMnO4的还原产物是Mn2+,引入新杂质Mn2+和K+,HNO3的还原产物是NO或NO2,虽然NO或NO2会从溶液中逸出,不会引入新杂质,但会污染环境,所以选择AC。
(5)用NaOH 标准溶液滴定H2SO4,操作依次为:检漏→水洗→加标准液,润洗内壁→从下口放出润洗液→装标准溶液,调液面,静置半分钟→取下滴定管,竖直,平视滴定管刻度读数→滴定,故答案为f c e d。
(6)A.“4)70℃”水浴加热相比于直接加热,有利于获得颗粒较大的晶体,便于过滤,正确;
B.[Co(NH3)5Cl]Cl2的溶解度随温度升高而增大,所以抽滤后,应该用冷水洗涤晶体,错误;
C.[Co(NH3)5Cl]Cl2溶于水,即使用冷水洗涤,也不可避免有部分溶于水,所以在洗涤液中一定会有Cl-,所以不能用检验Cl-的方法检验[Co(NH3)5Cl]Cl2是否洗涤干净,可以检验NH4+,错误;
D.抽滤结束,应先打开活塞K放气,再关掉抽气泵,正确;
故选AD。

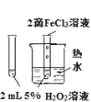
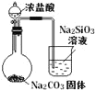
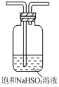
【题目】下列图中的实验,能达到实验目的的是
A | B | C | D | |
实验方案 |
|
|
|
|
实验 目的 | 验证FeCl3对H2O2分解反应有催化作用 | 比较HCl、H2CO3和H2SiO3的酸性强弱 | 除去SO2中的少量HCl | 准确量取20.00mL体积K2Cr2O7标准溶液 |
A. AB. BC. CD. D