题目内容
【题目】某学习小组的同学对氯气与铁的反应及产物进行了如下探究:
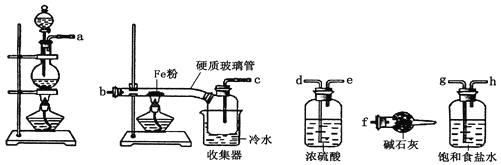
(1) 装置的连接顺序为a→_____→____→____→____→b→c→f。
(2) 硬质玻璃管中可观察到的现象是___________________;硬质玻璃管与收集器之间没有用导管连接,原因是____________________;反应一段时间、熄灭酒精灯,冷却后,将收集器及硬质玻璃管中物质快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

(3) 试剂X的化学式为___________;有同学分析淡黄色溶液中含有Fe2+,你认为_______(填“合理”或“不合理”);固体产物的成分可能为__________(填相应的字母);
A Fe和FeCl3 B FeCl2和FeCl3 C Fe、FeCl2和FeCl3 D Fe和FeCl2
(4) 加入少许植物油的作用是___________________,用离子方程式表示加入新制氯水后溶液红色加深的原因_______________________________。
(5) 某小组同学实验时在加入新制氯水后,并未得到深红色溶液,请帮助他们分析原因________,请设计实验对你所分析的原因进行验证,简要写出实验方案___________
(6)Cl2是一种黄绿色有刺激性气味的气体,实验室通常用NaOH溶液来吸收Cl2,以减少环境污染。若实验时需要450mL 4mol/L的NaOH溶液,则配制时,需要用托盘天平称取NaOH的质量为_______g,所使用的仪器除托盘天平、胶头滴管、玻璃棒外,还必须有_________。配制该溶液时,下列操作会使溶液浓度偏高的是___________。(填字母)
A 称量固体时动作缓慢 B 容量瓶未干燥立即用来配制溶液
C NaOH固体溶解后立刻转移 D 在容量瓶中定容时俯视容量瓶刻度线
E 定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
【答案】g h d e 有棕黄色的烟生成 防止堵塞 KSCN(或NH4SCN)溶液 合理 A 隔绝空气,防止Fe2+被氧化 2Fe2++Cl2=2Fe3++2Cl-、Fe3++SCN-=Fe(SCN)3 新制氯水将SCN-氧化 取少量褪色后的溶液于试管中,再滴加几滴KSCN(或NH4SCN)溶液,若溶液变红,则原因分析成立 80.0 500mL容量瓶、烧杯 CD
【解析】
(1)排列顺序为气体的制取→洗气→干燥→氯气和铁的反应→尾气处理;
(2)Fe在氯气中燃烧生成棕黄色烟,导气管口较细,易堵塞;
(3)Fe3+用KSCN溶液检验,Fe3+和KSCN反应生成络合物硫氰化铁而使溶液呈血红色;Fe和稀盐酸、氯化铁反应生成FeCl2;
(4)Fe2+不稳定而易被氧化;Fe2+被氯气氧化生成Fe3+,从而增大Fe3+浓度;
(5)Fe3+和KSCN反应生成络合物硫氰化铁而使溶液呈血红色,氯水具有强氧化性,能氧化还原性物质,如果Fe3+和KSCN混合溶液中加入氯水后未得到深红色溶液,说明溶液中硫氰化铁浓度未变大;
(6)根据配制一定物质的量浓度的溶液操作过程分析。
(1)浓硫酸具有吸水性能作氯气干燥剂、碱石灰具有碱性而吸收氯气、饱和食盐水吸收氯化氢而抑制氯气溶解,装置排列顺序为气体的制取→洗气→干燥→氯气和铁的反应→尾气处理,所以装置连接顺序为a→g→h→d→e→b→c→f,
故答案为:g;h;d;e;
(2)Fe在氯气中燃烧生成棕黄色烟,所以看到的现象是有棕黄色烟生成;棕黄色烟冷却易生成固体,导气管口较细,易堵塞,所以硬质玻璃管与收集器之间没有用导管连接,
故答案为:有棕黄色烟生成;防止堵塞;
(3)Fe3+用KSCN溶液检验,Fe3+和KSCN反应生成络合物硫氰化铁而使溶液呈血红色,所以试剂X为KSCN溶液;固体和氯气反应时可能没有完全反应,导致Fe和稀盐酸、氯化铁反应生成氯化亚铁,Fe和稀盐酸反应生成FeCl2,所以分析合理,固体中成分为Fe和FeCl3,
故答案为:KSCN;合理;A;
(4)Fe2+不稳定,易被空气中氧气氧化,所以植物油的作用是隔绝空气防止Fe2+被氧化;Fe2+被氯气氧化生成Fe3+,从而增大Fe3+浓度,Fe3+、SCN-反应生成Fe(SCN)3,从而增大络合物浓度,溶液颜色加深,涉及的反应方程式为2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3,
故答案为:隔绝空气,防止Fe2+被氧化; 2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3;
(5)Fe3+和KSCN反应生成络合物硫氰化铁而使溶液呈血红色,氯水具有强氧化性,能氧化还原性物质,如果Fe3+和KSCN混合溶液中加入氯水后未得到深红色溶液,说明溶液中硫氰化铁浓度未变大,则可能原因是新制氯水将SCN-氧化;其检验方法是:取少许褪色后的溶液于试管中,再滴加几滴KSCN溶液,若溶液变红,则原因分析成立,
故答案为:新制氯水将SCN-氧化;取少许褪色后的溶液于试管中,再滴加几滴KSCN溶液,若溶液变红,则原因分析成立;
(6)实验时需要450mL 4mol/L的NaOH溶液,需要取用500mL容量瓶中配制,配制溶液需要天平称量固体质量,精确到0.1g,依据m=nM计算需要的氢氧化钠溶质的质量=0.5L×4mol/L×40g/mol=80.0g,若实验时需要450mL 4mol/L的NaOH溶液,需要取用500mL容量瓶中配制,所使用的仪器除托盘天平、胶头滴管、玻璃棒外,还含有烧杯和500mL容量瓶,
A.称量固体时动作缓慢,可能导致氢氧化钠吸收水蒸气和空气中的二氧化碳,导致溶质减小,测定结果偏低,故A错误;
B.最后配制溶液需要加入水定容,容量瓶未干燥立即用来配制溶液对配制溶液的结果无影响,故B错误;
C.NaOH固体溶解后溶液温度升高,立刻转移溶液温度升高,常温下液面未达到刻度,溶液浓度增大,故C正确;
D.在容量瓶中定容时俯视容量瓶刻度线,定容未达到刻度,溶液浓度增大,故D正确;
E.定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线,水加入超出刻度线,溶液浓度减小,故E错误;
故选CD。