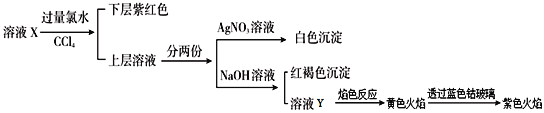
题目内容
【题目】次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)俗称吊白块,不稳定,120℃时会分解。在印染、医药以及原子能工业中有广泛应用。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
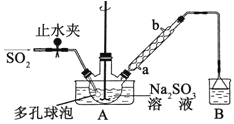
步骤1:在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3溶液。
步骤2:将装置A 中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,搅拌(防止生成沉淀覆盖在锌粉表面阻止反应进行),反应约3h,冷却至室温,抽滤;
步骤3:将滤液真空蒸发浓缩,冷却结晶。
⑴装置B 的烧杯中应加入的溶液是__________________________________________。
⑵A中多孔球泡的作用是_______________________________________________。
⑶冷凝管中回流的主要物质除H2O 外还有__________________________(填化学式)。
⑷写出步骤2中发生反应的化学方程式____________________________。
⑸步骤3中在真空容器中蒸发浓缩的原因是__________________________________。
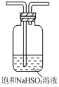
⑹①抽滤时使用如下装置,其中a和b的名称分别__________、 __________。中途停止抽滤时应 ___________________________以防倒吸。
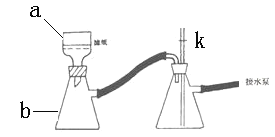
②如果抽滤的溶液具有强氧化性时,可采取_________________________________的措施
⑺为了测定产品的纯度,准确称取2.000g样品,完全溶于水配成100mL溶液,取20.00mL所配溶液,加入过量碘完全反应后(已知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g,则所制得的产品的纯度为____。
【答案】NaOH溶液 增大气体与溶液的接触面积,加快气体的吸收速率 HCHO NaHSO3+HCHO+Zn+H2O=NaHSO2HCHO+Zn(OH)2 防止温度过高产物分解,也防止氧气将产物氧化 布氏漏斗 吸滤瓶 慢慢打开活塞K,然后关闭水龙头 用玻璃砂漏斗代替布氏漏斗或玻璃纤维代替滤纸 77.0%
【解析】
由题意可知,装置A用于制备次硫酸氢钠甲醛,制备时三颈烧瓶中Na2SO3溶液先和SO2反应制得NaHSO3溶液,再在80~90℃水浴加热条件下,NaHSO3溶液与过量的锌粉和甲醛溶液反应生成次硫酸氢钠甲醛和氢氧化锌沉淀,装置B中氢氧化钠溶液用于吸收未反应的二氧化硫等气体,防止污染环境。
(1)装置B的作用是用氢氧化钠溶液吸收未反应的二氧化硫等气体,防止污染环境,故答案为:NaOH溶液;
(2)多孔球泡可以增大SO2气体与Na2SO3溶液的接触面积,加快气体的吸收速率,有利于NaHSO3溶液的生成,故答案为:增大气体与溶液的接触面积,加快气体的吸收速率;
(3)甲醛具有挥发性,在80~90℃温度下会大量挥发,使用冷凝管可以使甲醛冷凝回流,提高甲醛的利用率,则冷凝管中回流的主要物质是H2O和HCHO,故答案为:HCHO;
(4)步骤2中锌粉和甲醛溶液、NaHSO3溶液发生氧化还原反应生成次硫酸氢钠甲醛和氢氧化锌沉淀,反应方程式为NaHSO3+HCHO+Zn+H2O=NaHSO2HCHO+Zn(OH)2,故答案为:NaHSO3+HCHO+Zn+H2O=NaHSO2HCHO+Zn(OH)2;
(5)次硫酸氢钠甲醛具有强还原性,遇到空气中的氧气易被氧化,次硫酸氢钠甲醛不稳定,受热易分解,所以步骤3中在真空容器中蒸发浓缩的原因是防止温度过高使产物分解,也防止氧气将产物氧化,故答案为:防止温度过高使产物分解,也防止氧气将产物氧化;
(6)①抽滤的优点是加快过滤速度、得到较干燥的沉淀,抽滤装置是由抽滤泵和抽滤瓶组成,抽滤瓶是由a布氏漏斗和b吸滤瓶组成,当抽滤完毕或中途停止抽滤时应慢慢打开活塞K,平衡气压,然后关闭水龙头以防倒吸,故答案为:布氏漏斗;吸滤瓶;慢慢打开活塞K,然后关闭水龙头;
②当抽滤的溶液具有强酸性时,为防止滤纸被腐蚀,要用玻璃纤维代替滤纸或用玻璃砂漏斗代替布氏漏斗,故答案为:用玻璃砂漏斗代替布氏漏斗或玻璃纤维代替滤纸;
(7)由化学方程式NaHSO2HCHO2H2O+2I2=NaHSO4+4HI+HCHO和NaHSO4+BaCl2=BaSO4↓
+HCl+NaCl可得关系式:NaHSO2HCHO2H2O~BaSO4,硫酸钡的质量为0.466g,其物质的量为0.002mol,所以样品中纯NaHSO2HCHO2H2O的质量为0.002mol×50×154g/mol=1.54g,所以纯度=![]() ×100%=77.0%,故答案为:77.0%。
×100%=77.0%,故答案为:77.0%。

【题目】下列图中的实验,能达到实验目的的是
A | B | C | D | |
实验方案 |
|
|
|
|
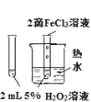
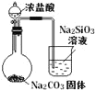
实验 目的 | 验证FeCl3对H2O2分解反应有催化作用 | 比较HCl、H2CO3和H2SiO3的酸性强弱 | 除去SO2中的少量HCl | 准确量取20.00mL体积K2Cr2O7标准溶液 |
A. AB. BC. CD. D