题目内容
【题目】如图是1mol金属镁和卤素反应的ΔH(单位:kJ·molˉ1)示意图,反应物和生成物均为常温时的稳定状态。下列选项中不正确的是
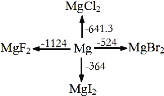
A.电解MgCl2制Mg是吸热反应
B.MgBr2与Cl2反应的ΔH<0
C.MgF2(s)+Br2(l) = MgBr2(s)+F2(g) ΔH=+600kJ·molˉ1
D.化合物的热稳定性顺序:MgI2>MgBr2>MgCl2>MgF2
【答案】D
【解析】
A.依据图象,Mg与Cl2反应的ΔH<0,为放热反应,则其逆过程电解MgCl2制Mg是吸热反应,故A正确;
B.依据图象,MgBr2能量高于MgCl2,依据活泼性判断,Cl2能量高于Br2,所以MgBr2与Cl2反应是放热反应,ΔH<0,故B正确;
C.反应的焓变=生成物总焓-反应物总焓;MgF2(s)的能量低于MgBr2(s),依据图象数据分析计算可知反应的焓变等于(-524 kJ/mol)-(-1124 kJ/mol)=600kJ/mol,故C正确;
D.物质的能量越低越稳定,根据图象数据,化合物的热稳定性顺序为:MgI2<MgBr2<MgCl2<MgF2,故D错误;
故选D。

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目