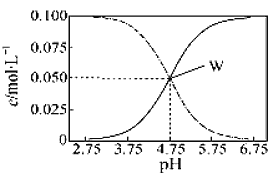
题目内容
【题目】一定条件下进行反应:COCl2(g)![]() Cl2 (g)+CO(g)。向2.0 L恒容密闭容器中充入1.0 mol COCl2 (g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
Cl2 (g)+CO(g)。向2.0 L恒容密闭容器中充入1.0 mol COCl2 (g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2) /mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法正确的是 ( )
A.保持其他条件不变,升高温度,平衡时c(Cl2) = 0.22 mol·L-1,则反应的 △H < 0
B.若在2 L恒容绝热(与外界没有热量变换)密闭容器进行该反应,化学平衡常数不变
C.保持其他条件不变,起始向容器中充入1.2 mol COCl2、0.60 mol Cl2和0.6 mol CO,反应达到平衡前的速率:v (正) > v (逆)
D.保持其他条件不变,起始向容器中充入1.0 mol Cl2和0.8 mol CO,达到平衡时,Cl2的转化率小于60%
【答案】D
【解析】
由表中数据可知,6s、8s时氯气的物质的量都是0.4mol,说明6s时反应到达平衡,平衡时氯气的浓度为0.2mol/L。
A. 由表中数据可知,6s、8s时氯气的物质的量都是0.4mol,说明6s时反应到达平衡,平衡时氯气的浓度为0.2mol/L,升高温度,到达新平衡,氯气的浓度变为0.22mol/L,氯气浓度增大,说明平衡向正反应方向移动,故正反应为吸热反应,即△H>0,故A错误;
B. 正反应为吸热反应,恒容绝热密闭容器进行该反应,随反应进行温度降低,而平衡常数只受温度影响,故平衡常数一定发生变化,故B错误;
C. 平衡时![]() ,列三段式:
,列三段式: ,该温度下平衡常数
,该温度下平衡常数![]() ,若起始向容器中充入1.2mol
,若起始向容器中充入1.2mol![]() 、0.60mol
、0.60mol![]() 和0.60mol
和0.60mol![]() ,此时
,此时![]() >0.13,则反应向逆反应方向移动,反应达到平衡前v正<v逆,故C错误;
>0.13,则反应向逆反应方向移动,反应达到平衡前v正<v逆,故C错误;
D. 原平衡等效为起始向容器中充入1.0mol![]() 和1.0mol
和1.0mol![]() ,达到平衡时
,达到平衡时![]() 的转化率
的转化率![]() ,如加入1.0mol
,如加入1.0mol![]() 和0.8mol
和0.8mol![]() ,相当于在原来的基础上减小0.2molCO,平衡在原来的基础上向正反应方向移动,则
,相当于在原来的基础上减小0.2molCO,平衡在原来的基础上向正反应方向移动,则![]() 的转化率减小,则
的转化率减小,则![]() 的转化率小于60%,故D正确。
的转化率小于60%,故D正确。
答案选D。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)。各容器中起始物质的量浓度与反应温度如下表所示:
N2(g)+2CO2(g)。各容器中起始物质的量浓度与反应温度如下表所示:
容器 | 温度/℃ | 起始物质的量浓度/(mol·L-1) | |||
NO(g) | CO(g) | N2 | CO2 | ||
甲 | T1 | 0.10 | 0.10 | 0 | 0 |
乙 | T2 | 0 | 0 | 0.10 | 0.20 |
丙 | T2 | 0.10 | 0.10 | 0 | 0 |
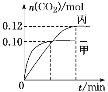
反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示。下列说法正确的是
A.该反应的正反应为放热反应,平衡常数K(T1)<K(T2)
B.乙容器中反应达到平衡时,N2的转化率小于40%
C.达到平衡时,乙容器中的压强一定大于甲容器的2倍
D.丙容器中反应达到平衡后,再充入0.10 mol NO和0.10 mol CO2,此时υ(正)<υ(逆)