题目内容
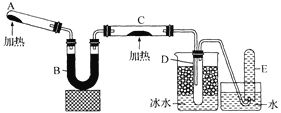
【题目】合成氨工业、硫酸工业的生产工艺流程大致为:

合成塔和接触室中的反应分别为:N2(g)+3H2(g)![]() 2NH3(g) △H﹤0; 2SO2(g)+O2(g)
2NH3(g) △H﹤0; 2SO2(g)+O2(g)![]() 2SO3(g) △H﹤0
2SO3(g) △H﹤0
(1)写出流程中设备的名称:B____________,X___________。
(2)进入合成塔和接触室中的气体都要进行热处理,最理想的热处理方法是_________________。
(3)采用循环操作可提高原料的利用率,下列生产中,采用循环操作的是____________(填序号)。
①硫酸工业 ②合成氨工业 ③硝酸工业
(4)工业上常用98.3%的浓硫酸吸收SO3而不用稀硫酸或水的原因是_______________________。
(5)工业生产中常用氨——酸法进行尾气脱硫,以达到消除污染、废物利用的目的。硫酸工业尾气中的SO2经处理可以得到一种化肥,该肥料的化学式是_____________。
【答案】循环压缩机 沸腾炉 逆流换热(或充分利用反应中放出的热量加热反应气) ①②③ 由于用稀硫酸或水吸收SO3时易形成酸雾,不利于SO3吸收 (NH4)2SO4
【解析】
(1)为了提高原料的利用率,合成氨工业中从氨分离器分离出的N2、H2要循环使用,由于合成氨工业需要高压,所以混合气进入合成塔之前要压缩,设备B为循环压缩机;根据工业制硫酸的原理,煅烧硫铁矿应在沸腾炉中进行,设备X为沸腾炉;
(2)由于合成氨和二氧化硫的催化氧化反应都是放热反应,为了充分利用热量,进入合成塔和接触室中的气体都要进行热处理,最理想的热处理方法是逆流换热(或充分利用反应中放出的热量加热反应气);
(3)只要在反应过程中使用的且在尾气处理器中还剩余的物质都可以循环利用,故选①②③;
(4)工业上常用98.3%的浓硫酸吸收SO3而不用稀硫酸或水的原因是:用稀硫酸或水吸收SO3时易形成酸雾,不利于SO3吸收;
(5)氨水吸收SO2后得到亚硫酸铵,亚硫酸铵与硫酸反应后得到硫酸铵和可循环使用的SO2,所得化肥的化学式为(NH4)2SO4。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g)ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=__________。平衡时H2的转化率为__________%。
2NH3(g)ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=__________。平衡时H2的转化率为__________%。
(2)平衡后,若提高H2的转化率,可以采取的措施有__________。
A.加了催化剂
B.增大容器体积
C.降低反应体系的温度
D.加入一定量N2
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)![]() 2NH3(g)ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g)ΔH<0,其化学平衡常数K与温度T的关系如表所示:
T/℃ | 200 | 300 | 400 |
K | K1 | K3 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1__________K2(填“<”“>”或“=”);
②400℃时,反应2NH3(g)![]() N2(g)+3H2(g)的化学平衡常数为__________。当测得NH3、N2和H2物质的量分别为3mol、2mol和1mol时,则该反应的v(N2)正__________v(N2)逆(填“<”“>”或“=”)。
N2(g)+3H2(g)的化学平衡常数为__________。当测得NH3、N2和H2物质的量分别为3mol、2mol和1mol时,则该反应的v(N2)正__________v(N2)逆(填“<”“>”或“=”)。
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是__________。
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益
【题目】一定条件下进行反应:COCl2(g)![]() Cl2 (g)+CO(g)。向2.0 L恒容密闭容器中充入1.0 mol COCl2 (g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
Cl2 (g)+CO(g)。向2.0 L恒容密闭容器中充入1.0 mol COCl2 (g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2) /mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法正确的是 ( )
A.保持其他条件不变,升高温度,平衡时c(Cl2) = 0.22 mol·L-1,则反应的 △H < 0
B.若在2 L恒容绝热(与外界没有热量变换)密闭容器进行该反应,化学平衡常数不变
C.保持其他条件不变,起始向容器中充入1.2 mol COCl2、0.60 mol Cl2和0.6 mol CO,反应达到平衡前的速率:v (正) > v (逆)
D.保持其他条件不变,起始向容器中充入1.0 mol Cl2和0.8 mol CO,达到平衡时,Cl2的转化率小于60%