题目内容
【题目】铬是一种银白色的坚硬金属,铬的工业用途很广,主要有金属加工、电镀、制革行业,这些行业排放的废水和废气是环境中的主要污染源。请回答下面与铬有关的一些问题。
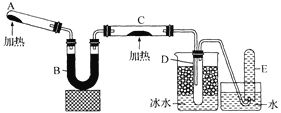
(1)工业上冶炼铬的主要步骤如图1所示:
①已知步骤Ⅱ的反应方程式为:8Na2CrO4+6Na2S+23H2O=8Cr(OH)3↓+3Na2S2O3+22NaOH。该反应中氧化剂是___(填化学式),生成1molCr(OH)3时转移电子的物质的量为___mol;
②步骤IV中电解Cr2O3的阳极反应式为___;
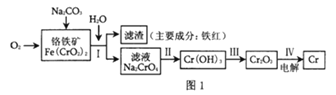
(2)某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如图2,A为电源的___(填“正极”“负极”),阳极区溶液中发生的氧化还原反应为___。
(3)化学需氧量(COD)可量度水体受有机物污染的程度。它是在强酸并加热条件下,用K2Cr2O7作强氧化剂处理水样时所消耗的K2Cr2O7的量,换算成相当于O2的含量(以mg/L计)。某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
Ⅰ.取VamL水样于锥形瓶,加入10.00mL0.2500mol/L K2Cr2O7溶液;
Ⅱ.加碎瓷片少许,然后慢慢加入少量硫酸,混合均匀,加热;
Ⅲ.反应完毕后,冷却,加指示剂,用cmol/L的硫酸亚铁铵(NH4)2Fe(SO4)2溶液滴定。终点时消耗硫酸亚铁铵溶液VbmL(此步操作的目的是用Fe2+把多余的Cr2O72-反应成Cr3+)。
①Ⅰ中,量取K2Cr2O7溶液的仪器是___;
②Ⅱ中,碎瓷片的作用是___;
③该水样的化学需氧量COD=___(用含c、Va、Vb的表达式表示)。
【答案】Na2CrO4 3 2O2--4e-=O2↑ 正极 Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 酸式滴定管(或移液管) 防止暴沸 8000×![]()
【解析】
(1)①根据化合价升降法判断、计算;
②步骤IV中电解Cr2O3的阳极反应为氧离子失去电子生成氧气;
(2)由图可知,B端生成氢气,则B端氢离子得到电子,B为负极,A为正极;阳极反应生成的Fe2+与Cr2O72-发生氧化还原反应;
(3)①K2Cr2O7溶液具有氧化性;
②碎瓷片可防止液体剧烈沸腾;
③根据转移电子数目相等计算。
(1)①8Na2CrO4+6Na2S+23H2O=8Cr(OH)3↓+3Na2S2O3+22NaOH中,Cr元素的化合价由+6价降低为+3价,则Na2CrO4为氧化剂,反应中生成1mol Cr(OH)3时转移电子1mol×(6-3)=3mol;
②步骤IV中电解Cr2O3的阳极反应为氧离子失去电子生成氧气,阳极反应式为2O2--4e-=O2↑;
(2)由图可知,B端生成氢气,则B端氢离子得到电子,B为负极,A为正极;阳极反应式为Fe-2e-=Fe2+,Fe2+与Cr2O72-发生氧化还原反应,则阳极区发生的氧化还原反应为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(3)①K2Cr2O7溶液具有氧化性,能腐蚀橡胶管,则量取K2Cr2O7溶液的仪器为酸式滴定管![]() 或移液管
或移液管![]() ;
;
②碎瓷片可防止液体剧烈沸腾,其作用为防止暴沸;
③I中废水中还原性物质与K2Cr2O7溶液发生氧化还原反应,Ⅲ中Fe2+把多余的Cr2O72-反应成Cr3+,由电子守恒可知,VamL废液中还原性物质失去的电子为0.01L×0.25mol/L×2×3-cmol/L×Vb×10-3L=![]() mol,由电子守恒,O2的含量n(O2)=
mol,由电子守恒,O2的含量n(O2)=![]() mol,则COD=
mol,则COD=![]() mol ×32g/mol×1000mg/g÷(Va×10-3L)=
mol ×32g/mol×1000mg/g÷(Va×10-3L)=![]() mg/L。
mg/L。

 阅读快车系列答案
阅读快车系列答案【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
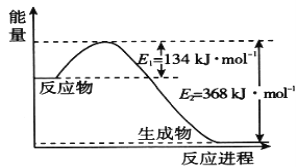
(1)如图是1 mol NO2和1 mol CO反应生成CO2 和NO过程中的能量变化示意图,请写出NO2 和CO反应的热化学方程式 _________________________________________。
(2)在0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,其化学平衡常数 K 与温度 T 的关系如下表:
2NH3(g) ΔH<0,其化学平衡常数 K 与温度 T 的关系如下表:
T/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请回答下列问题:
①试比较K1、K2的大小,K1 ______ K2(填“>”、“=” 或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是_________(填序号字母)。
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.3v正(N2) = v逆(H2)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应 2NH3(g) ![]() N2(g) + 3H2(g) 的平衡常数K为_________。当测得NH3、N2、H2的浓度分别为3 mol L1、2 mol L1、1 mol L1时,则该反应的v正(N2)______v逆(N2)(填“>”、“=” 或“<”)。
N2(g) + 3H2(g) 的平衡常数K为_________。当测得NH3、N2、H2的浓度分别为3 mol L1、2 mol L1、1 mol L1时,则该反应的v正(N2)______v逆(N2)(填“>”、“=” 或“<”)。
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-58 kJ·mol1),在其他条件不变时,温度T1、T2对反应的影响图像如图。
CH3OH(g)+H2O(g) ΔH=-58 kJ·mol1),在其他条件不变时,温度T1、T2对反应的影响图像如图。
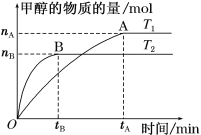
①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=______mol·L1·min1。
②图示的温度T1______T2(填“>”、“=” 或“<”)。
【题目】某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解 |
(1)实验室用18.4molL-1的浓硫酸配制250mL4.8molL-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和移液管(一种能精确量取一定体积液体的仪器)外,还需___。
(2)酸浸时,为了提高浸取率可采取的措施是___(至少两条)。
(3)加入H2O2的作用是___。
(4)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是___。
(5)还原过程发生以下反应(请配平):__Na2Cr2O7+__SO2+__=__Cr(OH)(H2O)5SO4+__Na2SO4;
(6)从流程的滤液中可回收的主要物质是___。
【题目】I.红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的ΔH表示生成1mol产物的数据),根据下图回答下列问题:

(1)PCl5分解生成PCl3和Cl2的热化学方程式____________________;上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.8molPCl5,反应达到平衡时还剩余0.6molPCl5,其分解率α1等于________;若反应温度由T1升高到T2,平衡时PCl5的分解率α2,α2________α1(填“大于”、“小于”或“等于”)。
(2)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是_________________________________________________。
(3)P和Cl2分两步反应生成1molPCl5的ΔH3=____________。
Ⅱ.某学生做浓度对化学反应速率的影响的实验时,将2支试管编号为①②,并按下表中物质的量进行实验,记录的时间数据是:16s、28s。请将2个数据填入下表的适当位置,并写出实验结论。
试管编号 | 加入3%Na2S2O3 | 加H2O | 加稀盐酸(1∶5) | 出现浑浊时间 |
① | 3mL | 3mL | 5滴 | a._____s |
② | 4mL | 2mL | 5滴 | b._____s |
(1)将对应①②的时间分别写出:a.____________,b.____________。
(2)实验结论____________________________________。
(3)写出反应的化学方程式_______________________________________________。
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g)ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=__________。平衡时H2的转化率为__________%。
2NH3(g)ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=__________。平衡时H2的转化率为__________%。
(2)平衡后,若提高H2的转化率,可以采取的措施有__________。
A.加了催化剂
B.增大容器体积
C.降低反应体系的温度
D.加入一定量N2
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)![]() 2NH3(g)ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g)ΔH<0,其化学平衡常数K与温度T的关系如表所示:
T/℃ | 200 | 300 | 400 |
K | K1 | K3 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1__________K2(填“<”“>”或“=”);
②400℃时,反应2NH3(g)![]() N2(g)+3H2(g)的化学平衡常数为__________。当测得NH3、N2和H2物质的量分别为3mol、2mol和1mol时,则该反应的v(N2)正__________v(N2)逆(填“<”“>”或“=”)。
N2(g)+3H2(g)的化学平衡常数为__________。当测得NH3、N2和H2物质的量分别为3mol、2mol和1mol时,则该反应的v(N2)正__________v(N2)逆(填“<”“>”或“=”)。
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是__________。
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益
【题目】一定条件下进行反应:COCl2(g)![]() Cl2 (g)+CO(g)。向2.0 L恒容密闭容器中充入1.0 mol COCl2 (g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
Cl2 (g)+CO(g)。向2.0 L恒容密闭容器中充入1.0 mol COCl2 (g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2) /mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法正确的是 ( )
A.保持其他条件不变,升高温度,平衡时c(Cl2) = 0.22 mol·L-1,则反应的 △H < 0
B.若在2 L恒容绝热(与外界没有热量变换)密闭容器进行该反应,化学平衡常数不变
C.保持其他条件不变,起始向容器中充入1.2 mol COCl2、0.60 mol Cl2和0.6 mol CO,反应达到平衡前的速率:v (正) > v (逆)
D.保持其他条件不变,起始向容器中充入1.0 mol Cl2和0.8 mol CO,达到平衡时,Cl2的转化率小于60%