题目内容
【题目】奈必洛尔是一种用于血管扩张的降血压药物,

已知:乙酸酐的结构简式为![]() 。
。
请回答下列问题:
(1)B的分子式为______________,反应①的反应类型为________________
(2)C所含官能团的名称为__________________________________________。
(3)反应⑤的化学方程式为_________________,该反应的反应类型是_________________。
(4)写出满足下列条件的E的同分异构体的结构简式:___________、______________。
Ⅰ.苯环上只有三个取代基
Ⅱ.核磁共振氢谱图中只有4组吸收峰
Ⅲ.1mol该物质与足量NaHCO3溶液反应生成2molCO2
(5)根据已有知识并结合相关信息,写出以![]() 为原料制备
为原料制备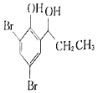 的合成路线流程图(无机试剂任选)_____________。(合成路线流程图示例如下:CH3CH2Br
的合成路线流程图(无机试剂任选)_____________。(合成路线流程图示例如下:CH3CH2Br![]() CH3CH2OHCH3COOCH2CH3)
CH3CH2OHCH3COOCH2CH3)
【答案】C8H7O2F 取代 氟原子、羰基、羟基 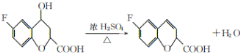 消去反应
消去反应 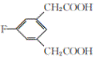
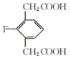

【解析】
A发生取代反应生成B,F与氢气反应生成G,对比E、G的结构,则F结构简式为:![]() ,反应⑤为醇羟基的消去反应;
,反应⑤为醇羟基的消去反应;
(5)由路线中B→C的转化,![]() 在AlCl3的催化作用下转化为
在AlCl3的催化作用下转化为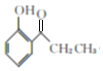 ,再与氢气加成生成
,再与氢气加成生成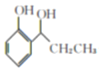 ,最后与溴发生取代反应生成
,最后与溴发生取代反应生成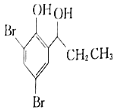 。
。
(1)B的结构简式为 ,则分子式为C8H7O2F;反应①是
,则分子式为C8H7O2F;反应①是![]() 发生取代反应生成
发生取代反应生成 ;
;
(2)C的结构简式为 ,所含官能团的名称为氟原子、羰基、酚羟基;
,所含官能团的名称为氟原子、羰基、酚羟基;
(3) F结构简式为:![]() ,E发生消去反应生成F,则反应⑤的化学方程式为
,E发生消去反应生成F,则反应⑤的化学方程式为 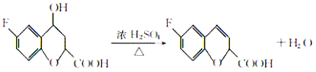 ,该反应的反应类型是消去反应;
,该反应的反应类型是消去反应;
(4) E的同分异构体符合下列条件:Ⅰ.苯环上只有三个取代基;Ⅱ.核磁共振氢谱图中只有4组吸收峰,说明含有4种氢原子;Ⅲ.1mol该物质与足量NaHCO3溶液反应生成2molCO2,则说明含有2个羧基,符合条件的E的同分异构体结构简式为: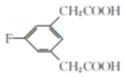 、
、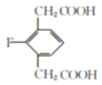 ;
;
(5) 由路线中B→C的转化,![]() 在AlCl3的催化作用下转化为
在AlCl3的催化作用下转化为 ,再与氢气加成生成
,再与氢气加成生成 ,最后与溴发生取代反应生成
,最后与溴发生取代反应生成 ,合成路线流程图为:
,合成路线流程图为: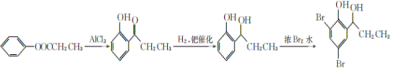 。
。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】现有室温下四种溶液,有关叙述不正确的是( )
编号 | ① | ② | ③ | ④ |
pH | 10 | 10 | 4 | 4 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A.相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B.分别加水稀释10倍,四种溶液的pH:①>②>④>③
C.①、④两溶液等体积混合,所得溶液为碱性
D.VaL④溶液与VbL②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va︰Vb=9︰11
【题目】I.红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的ΔH表示生成1mol产物的数据),根据下图回答下列问题:

(1)PCl5分解生成PCl3和Cl2的热化学方程式____________________;上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.8molPCl5,反应达到平衡时还剩余0.6molPCl5,其分解率α1等于________;若反应温度由T1升高到T2,平衡时PCl5的分解率α2,α2________α1(填“大于”、“小于”或“等于”)。
(2)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是_________________________________________________。
(3)P和Cl2分两步反应生成1molPCl5的ΔH3=____________。
Ⅱ.某学生做浓度对化学反应速率的影响的实验时,将2支试管编号为①②,并按下表中物质的量进行实验,记录的时间数据是:16s、28s。请将2个数据填入下表的适当位置,并写出实验结论。
试管编号 | 加入3%Na2S2O3 | 加H2O | 加稀盐酸(1∶5) | 出现浑浊时间 |
① | 3mL | 3mL | 5滴 | a._____s |
② | 4mL | 2mL | 5滴 | b._____s |
(1)将对应①②的时间分别写出:a.____________,b.____________。
(2)实验结论____________________________________。
(3)写出反应的化学方程式_______________________________________________。
【题目】一定条件下进行反应:COCl2(g)![]() Cl2 (g)+CO(g)。向2.0 L恒容密闭容器中充入1.0 mol COCl2 (g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
Cl2 (g)+CO(g)。向2.0 L恒容密闭容器中充入1.0 mol COCl2 (g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2) /mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法正确的是 ( )
A.保持其他条件不变,升高温度,平衡时c(Cl2) = 0.22 mol·L-1,则反应的 △H < 0
B.若在2 L恒容绝热(与外界没有热量变换)密闭容器进行该反应,化学平衡常数不变
C.保持其他条件不变,起始向容器中充入1.2 mol COCl2、0.60 mol Cl2和0.6 mol CO,反应达到平衡前的速率:v (正) > v (逆)
D.保持其他条件不变,起始向容器中充入1.0 mol Cl2和0.8 mol CO,达到平衡时,Cl2的转化率小于60%
【题目】中国科学家创造性地构建了硅化物晶格限域的单铁中心催化剂,成功地实现了甲烷在无氧条件下选择活化,一步高效生产乙烯、芳烃和氢气等化学品。请回答下列问题:
(1)基态铁原子的价层电子轨道表达式为______。
(2)硅、碳位于同一主族,用“![]() ”“
”“![]() ”或“
”或“![]() ”填空:
”填空:
性质 | 原子半径 | 第一电离能 | 熔点 | 键能 |
项目 |
|
|
|
|
(3)CN-能与Fe3+形成配合物,与CN-互为等电子体的分子有______ (任写一种);1 mol[Fe(CN)6 ]3-中含______molσ键。
(4)已知:反应![]() ,碳原子的杂化类型转化过程为______;
,碳原子的杂化类型转化过程为______;
从共价键重叠方式看,![]() 分子中
分子中![]() 键类型为;
键类型为;![]() 的键角比
的键角比![]() 的键角______
的键角______![]() 填“大”或“小”
填“大”或“小”![]() 。
。
(5)晶体有两种晶胞,如图1、图2所示。

图1中晶胞中铁的配位数为______;图2中铁晶胞堆积方式为______。
(6)碳化硅晶胞如图3所示,已知碳化硅晶体的密度为dgcm-3,NA表示阿伏加德罗常数的值,则碳化硅中硅碳键的键长为______ pm。