题目内容
【题目】25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述不正确的是( )
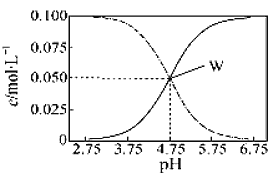
A.pH=5.5的溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
B.W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-)
C.pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol·L-1
D.向W点所表示的1.0L溶液中通入0.05molHCl气体(忽略溶液体积变化):c(H+)=c(CH3COOH)+c(OH-)
【答案】D
【解析】
A. 从图中可以看出,pH=5.5的溶液中:c(CH3COO-)>c(CH3COOH),此时溶液呈酸性,
c(H+)>c(OH-),从数据中可以看出,c(CH3COOH) >c(H+),所以 c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-),A正确;
B. W点所表示的溶液中,按电荷守恒,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),因为在W点,c(CH3COOH)= c(CH3COO-),所以c(Na+)+c(H+)=c(CH3COOH)+c(OH-),B正确;
C. pH=3.5的溶液中,c(Na+)+c(H+)-c(OH-)=c(CH3COO-)=0.1 mol·L-1- c(CH3COOH),所以c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol·L-1,C正确;
D. 向W点所表示的1.0L溶液中通入0.05molHCl气体,刚好与CH3COO-完全反应生成CH3COOH,此时溶液中存在以下电离平衡:CH3COOH![]() CH3COO-+H+、H2O
CH3COO-+H+、H2O![]() H++OH-,c(H+)=c(CH3COO-)+c(OH-),而此时c(CH3COOH)> c(CH3COO-),所以c(H+)<c(CH3COOH)+c(OH-),D错误。
H++OH-,c(H+)=c(CH3COO-)+c(OH-),而此时c(CH3COOH)> c(CH3COO-),所以c(H+)<c(CH3COOH)+c(OH-),D错误。
故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
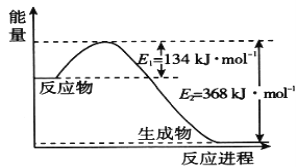
(1)如图是1 mol NO2和1 mol CO反应生成CO2 和NO过程中的能量变化示意图,请写出NO2 和CO反应的热化学方程式 _________________________________________。
(2)在0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,其化学平衡常数 K 与温度 T 的关系如下表:
2NH3(g) ΔH<0,其化学平衡常数 K 与温度 T 的关系如下表:
T/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请回答下列问题:
①试比较K1、K2的大小,K1 ______ K2(填“>”、“=” 或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是_________(填序号字母)。
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.3v正(N2) = v逆(H2)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应 2NH3(g) ![]() N2(g) + 3H2(g) 的平衡常数K为_________。当测得NH3、N2、H2的浓度分别为3 mol L1、2 mol L1、1 mol L1时,则该反应的v正(N2)______v逆(N2)(填“>”、“=” 或“<”)。
N2(g) + 3H2(g) 的平衡常数K为_________。当测得NH3、N2、H2的浓度分别为3 mol L1、2 mol L1、1 mol L1时,则该反应的v正(N2)______v逆(N2)(填“>”、“=” 或“<”)。
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-58 kJ·mol1),在其他条件不变时,温度T1、T2对反应的影响图像如图。
CH3OH(g)+H2O(g) ΔH=-58 kJ·mol1),在其他条件不变时,温度T1、T2对反应的影响图像如图。
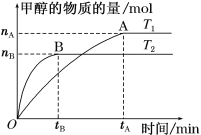
①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=______mol·L1·min1。
②图示的温度T1______T2(填“>”、“=” 或“<”)。
【题目】现有室温下四种溶液,有关叙述不正确的是( )
编号 | ① | ② | ③ | ④ |
pH | 10 | 10 | 4 | 4 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A.相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B.分别加水稀释10倍,四种溶液的pH:①>②>④>③
C.①、④两溶液等体积混合,所得溶液为碱性
D.VaL④溶液与VbL②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va︰Vb=9︰11
【题目】某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解 |
(1)实验室用18.4molL-1的浓硫酸配制250mL4.8molL-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和移液管(一种能精确量取一定体积液体的仪器)外,还需___。
(2)酸浸时,为了提高浸取率可采取的措施是___(至少两条)。
(3)加入H2O2的作用是___。
(4)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是___。
(5)还原过程发生以下反应(请配平):__Na2Cr2O7+__SO2+__=__Cr(OH)(H2O)5SO4+__Na2SO4;
(6)从流程的滤液中可回收的主要物质是___。
【题目】一定条件下进行反应:COCl2(g)![]() Cl2 (g)+CO(g)。向2.0 L恒容密闭容器中充入1.0 mol COCl2 (g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
Cl2 (g)+CO(g)。向2.0 L恒容密闭容器中充入1.0 mol COCl2 (g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2) /mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法正确的是 ( )
A.保持其他条件不变,升高温度,平衡时c(Cl2) = 0.22 mol·L-1,则反应的 △H < 0
B.若在2 L恒容绝热(与外界没有热量变换)密闭容器进行该反应,化学平衡常数不变
C.保持其他条件不变,起始向容器中充入1.2 mol COCl2、0.60 mol Cl2和0.6 mol CO,反应达到平衡前的速率:v (正) > v (逆)
D.保持其他条件不变,起始向容器中充入1.0 mol Cl2和0.8 mol CO,达到平衡时,Cl2的转化率小于60%