题目内容
【题目】坦桑石是一种世界公认的新兴宝石,这种宝石于1967年首次在赤道雪山脚下的阿鲁沙地区被发现。坦桑石的主要化学成分为![]() ,还可含有V、Cr、Mn等元素。
,还可含有V、Cr、Mn等元素。
![]() 下列状态的铝中,电离最外层的一个电子所需能量最大的是________
下列状态的铝中,电离最外层的一个电子所需能量最大的是________![]() 填序号
填序号![]() 。
。
①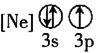 ②
②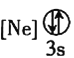 ③
③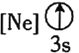 ④
④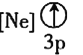
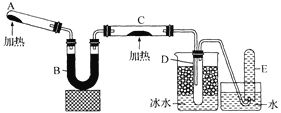
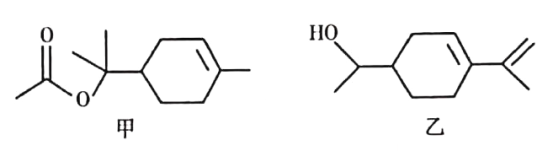
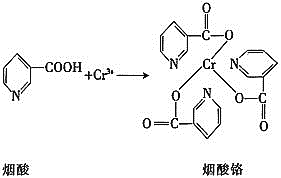
![]() 烟酸铬是铬的一种化合物,其合成过程如下:
烟酸铬是铬的一种化合物,其合成过程如下:
![]() 核外电子排布式为________。
核外电子排布式为________。
![]() 、C、N、O的电负性由大到小的顺序是_________。
、C、N、O的电负性由大到小的顺序是_________。
![]() 烟酸中碳、氮原子的杂化方式分别为________、________。
烟酸中碳、氮原子的杂化方式分别为________、________。
![]() 分子中的大
分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数
键的电子数![]() 如二氧化碳分子中的大
如二氧化碳分子中的大![]() 键可表示为
键可表示为![]() ,则烟酸中的大
,则烟酸中的大![]() 键应表示为___________。
键应表示为___________。
![]() 、
、![]() 都极易水解。
都极易水解。![]() 、
、![]() 都属于______
都属于______![]() 填“极性”或“非极性”
填“极性”或“非极性”![]() 分子,其熔点的关系为
分子,其熔点的关系为![]() ________
________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 将Mn掺入GaAs晶体
将Mn掺入GaAs晶体![]() 图甲
图甲![]() 可得到稀磁性半导体材料
可得到稀磁性半导体材料![]() 图乙
图乙![]() ,图甲、图乙晶体结构不变。
,图甲、图乙晶体结构不变。
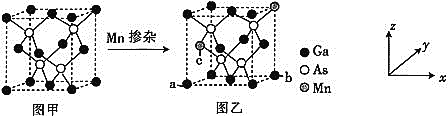
![]() 图乙中a点和b点的原子坐标参数分别为
图乙中a点和b点的原子坐标参数分别为![]() 0,
0,![]() 和
和![]() 1,
1,![]() ,则c点的原子坐标参数为________。
,则c点的原子坐标参数为________。
![]() 设图甲晶体的密度为
设图甲晶体的密度为![]() ,用
,用![]() 表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个镓原子之间的距离为________________pm。
表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个镓原子之间的距离为________________pm。
【答案】![]()
![]()
![]()
![]()
![]()
![]() 非极性
非极性 ![]()
![]()
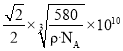
【解析】
![]() 依据铝的第三电离能大于第二电离能,大于第一电离能判断;
依据铝的第三电离能大于第二电离能,大于第一电离能判断;
![]() Cr为24号元素,基态原子核外电子排布式为
Cr为24号元素,基态原子核外电子排布式为![]() ;
;
![]() 已知H、C、N、O四种中,H的电负性最小,而C、N、O处于同周期,电负性自左而右增大;
已知H、C、N、O四种中,H的电负性最小,而C、N、O处于同周期,电负性自左而右增大;
![]() 烟酸中杂环上的碳、氮原子含有2个
烟酸中杂环上的碳、氮原子含有2个![]() 键和一个孤电子对;
键和一个孤电子对;
![]() 烟酸中杂环上的碳原子和氮原子均以
烟酸中杂环上的碳原子和氮原子均以![]() 杂化轨道相互重叠形成
杂化轨道相互重叠形成![]() 键,构成一个平面六元环,且六个原子上有一个p轨道垂直于环平面,每个p轨道中有一个电子,这些p轨道侧面重叠形成一个封闭的大
键,构成一个平面六元环,且六个原子上有一个p轨道垂直于环平面,每个p轨道中有一个电子,这些p轨道侧面重叠形成一个封闭的大![]() 键,
键,![]() 电子数目为6;
电子数目为6;
![]() ,
,![]() 分子空间构型都为正四面体结构,所以它们都属于非极性分子;
分子空间构型都为正四面体结构,所以它们都属于非极性分子;
![]() a点和b点的原子坐标参数分别为
a点和b点的原子坐标参数分别为![]() 0,
0,![]() 和
和![]() 1,
1,![]() ,而c点所在的位置为一个正方形的中心;
,而c点所在的位置为一个正方形的中心;
![]() 先用均摊法确定GaAs晶体的化学式,即Ga原子数为
先用均摊法确定GaAs晶体的化学式,即Ga原子数为![]() ,而As正好处于晶胞体内,As原子个数为4,因此GaAs晶体的化学式为
,而As正好处于晶胞体内,As原子个数为4,因此GaAs晶体的化学式为![]() ,其摩尔质量为
,其摩尔质量为![]() ,则一个晶胞质量为
,则一个晶胞质量为![]() ,由
,由![]() m
m![]() 的出晶胞体积
的出晶胞体积![]() ,再计算边长即可。
,再计算边长即可。
![]() 依据铝的第三电离能大于第二电离能,大于第一电离能;基态大于激发态,故
依据铝的第三电离能大于第二电离能,大于第一电离能;基态大于激发态,故![]() 所需的能量最大,故答案为:
所需的能量最大,故答案为:![]() ;
;
![]() Cr为24号元素,基态原子核外电子排布式为
Cr为24号元素,基态原子核外电子排布式为![]() ,则
,则![]() 核外电子排布式为
核外电子排布式为![]() ;
;
![]() 已知H、C、N、O四种中,H的电负性最小,而C、N、O处于同周期,电负性自左而右增大,所以它们电负性由大到小排列为
已知H、C、N、O四种中,H的电负性最小,而C、N、O处于同周期,电负性自左而右增大,所以它们电负性由大到小排列为![]() ;
;
![]() 烟酸中杂环上的碳、氮原子含有2个
烟酸中杂环上的碳、氮原子含有2个![]() 键和一个孤电子对,且支链羧基碳原子也是
键和一个孤电子对,且支链羧基碳原子也是![]() 杂化,所以烟酸中C、N原子的杂化轨道类型为
杂化,所以烟酸中C、N原子的杂化轨道类型为![]() ;
;
![]() 烟酸中杂环上的碳原子和氮原子均以
烟酸中杂环上的碳原子和氮原子均以![]() 杂化轨道相互重叠形成
杂化轨道相互重叠形成![]() 键,构成一个平面六元环,且六个原子上有一个p轨道垂直于环平面,每个p轨道中有一个电子,这些p轨道侧面重叠形成一个封闭的大
键,构成一个平面六元环,且六个原子上有一个p轨道垂直于环平面,每个p轨道中有一个电子,这些p轨道侧面重叠形成一个封闭的大![]() 键,
键,![]() 电子数目为6,则烟酸中的大
电子数目为6,则烟酸中的大![]() 键应表示为
键应表示为![]() ;
;
![]() ,
,![]() 分子空间构型都为正四面体结构,所以它们都属于非极性分子;而相对分子质量越大,分子间作用力越大,其熔点关系:
分子空间构型都为正四面体结构,所以它们都属于非极性分子;而相对分子质量越大,分子间作用力越大,其熔点关系:![]() ;
;
![]() a点和b点的原子坐标参数分别为
a点和b点的原子坐标参数分别为![]() 0,
0,![]() 和
和![]() 1,
1,![]() ,而c点所在的位置为一个正方形的中心,则c点的原子坐标参数为
,而c点所在的位置为一个正方形的中心,则c点的原子坐标参数为![]() ;
;
![]() 先用均摊法确定GaAs晶体的化学式,即Ga原子数为
先用均摊法确定GaAs晶体的化学式,即Ga原子数为![]() ,而As正好处于晶胞体内,As原子个数为4,因此GaAs晶体的化学式为
,而As正好处于晶胞体内,As原子个数为4,因此GaAs晶体的化学式为![]() ,其摩尔质量为
,其摩尔质量为![]() ,则一个晶胞质量为
,则一个晶胞质量为![]() ,由
,由![]() m
m![]() 的出晶胞体积
的出晶胞体积![]() 则边长为
则边长为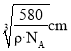 ,而甲晶体中最近的两个Ga原子正好位于面心和顶点,距离为
,而甲晶体中最近的两个Ga原子正好位于面心和顶点,距离为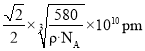 。
。

 阅读快车系列答案
阅读快车系列答案【题目】一定条件下进行反应:COCl2(g)![]() Cl2 (g)+CO(g)。向2.0 L恒容密闭容器中充入1.0 mol COCl2 (g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
Cl2 (g)+CO(g)。向2.0 L恒容密闭容器中充入1.0 mol COCl2 (g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2) /mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法正确的是 ( )
A.保持其他条件不变,升高温度,平衡时c(Cl2) = 0.22 mol·L-1,则反应的 △H < 0
B.若在2 L恒容绝热(与外界没有热量变换)密闭容器进行该反应,化学平衡常数不变
C.保持其他条件不变,起始向容器中充入1.2 mol COCl2、0.60 mol Cl2和0.6 mol CO,反应达到平衡前的速率:v (正) > v (逆)
D.保持其他条件不变,起始向容器中充入1.0 mol Cl2和0.8 mol CO,达到平衡时,Cl2的转化率小于60%
【题目】兴趣小组设计实验,测定![]() 与
与![]() 混合物中
混合物中![]() 的质量分数.
的质量分数.
甲方案:
实验步骤为:
![]() 称量空坩埚的质量为
称量空坩埚的质量为![]() ;
;![]() 称量装有试样的坩埚质量为
称量装有试样的坩埚质量为![]() ;
;
![]() 加热;
加热;
![]() 冷却;
冷却;
![]() 称量坩埚和残余物的质量为
称量坩埚和残余物的质量为![]() ;
;
![]() 重复
重复![]() 至
至![]() 操作,直至恒重,质量为
操作,直至恒重,质量为![]() 。
。
(1)坩埚中发生反应的化学方程式___________________________。
(2)计算![]() 质量分数为 _____________________________
质量分数为 _____________________________![]() 表达式
表达式![]() 。
。
乙方案:
准确称取![]() 样品,放锥形瓶中,加入适量水溶解,滴入2滴酚酞试液,用
样品,放锥形瓶中,加入适量水溶解,滴入2滴酚酞试液,用![]() 的标准盐酸滴定至溶液由粉红色刚好变为无色,达到滴定终点时产物为
的标准盐酸滴定至溶液由粉红色刚好变为无色,达到滴定终点时产物为![]() ,即
,即![]() 。重复上述操作两次。
。重复上述操作两次。
![]() 配制上述盐酸标准溶液100ml,若用
配制上述盐酸标准溶液100ml,若用![]() 进行配制,需用量筒量取该HCl溶液________ml;定容时俯视刻度线,将导致配制的溶液浓度________。
进行配制,需用量筒量取该HCl溶液________ml;定容时俯视刻度线,将导致配制的溶液浓度________。![]() 填“偏高”、“偏低”或“没有影响”
填“偏高”、“偏低”或“没有影响”![]()
(4)根据下表数据,样品中![]() _________。
_________。![]() 保留三位有效数字
保留三位有效数字![]()
滴定次数 | 样品的质量 | 稀盐酸的体积 | |
滴定前刻度 | 滴定后刻度 | ||
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
丙方案:称取![]() 样品,选用下图部分装置测定样品与硫酸反应生成的气体体积。
样品,选用下图部分装置测定样品与硫酸反应生成的气体体积。
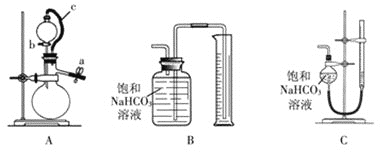
(5)某同学按以下方法检查装置A的气密性:在分液漏斗中加入适量水,如图连接好装置,关闭止水夹a,用止水夹夹住橡皮管c,打开活塞b。若分液漏斗中的水无法持续滴下,试判断装置A是否漏气?________![]() 填“漏气”、“不漏气”或“无法确定”
填“漏气”、“不漏气”或“无法确定”![]() 。实验时,装置A中c的作用_____________________,________________。
。实验时,装置A中c的作用_____________________,________________。
(6)为了提高测定的准确性,应选用装置A和_____![]() 填写字母标号
填写字母标号![]() 进行实验。
进行实验。