题目内容
20.酯类是工业上重要的有机原料,具有广泛用途.如图是乙酸乙酯的合成路线图,已知A能与银氨溶液反应析出银镜,B的水溶液可以溶解CaCO3,E可作果实催熟剂.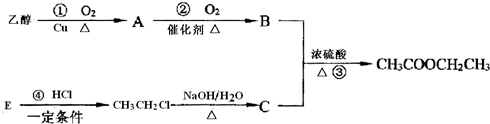
请完成下列问题:
(1)A的名称是乙醛;B中所含的官能团是羧基(或-COOH);反应③的类型是酯化(或取代反应);反应④的类型是加成反应.
(2)A的结构简式为CH3CHO;E的结构简式为CH2=CH2.
(3)请写出反应③、④的化学方程式:③CH3CH2OH+CH3COOH
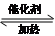 CH3COOCH2CH3+H2O;④CH2=CH2+HCl
CH3COOCH2CH3+H2O;④CH2=CH2+HCl CH3CH2Cl.
CH3CH2Cl.(4)请写出CH3COOCH2CH3的酯类物质的同分异构体的结构简式(写两种即可)HCOOCH2CH2CH3或HCOOCH(CH3)2.
分析 合成乙酸乙酯需要乙醇和乙酸在浓硫酸作用下完成,则B、C为乙醇和乙酸;B的水溶液可以溶解CaCO3,则B为CH3COOH、C为CH3CH2OH;乙醇催化氧化生成A,且A能与银氨溶液反应析出银镜,则A为乙醛;E可作果实催熟剂,能够与氯化氢反应生成氯乙烷,则E为CH2=CH2,据此进行解答.
解答 解:合成乙酸乙酯需要乙醇和乙酸在浓硫酸作用下完成,则B、C为乙醇和乙酸;B的水溶液可以溶解CaCO3,则B为CH3COOH、C为CH3CH2OH;乙醇催化氧化生成A,且A能与银氨溶液反应析出银镜,则A为乙醛;E可作果实催熟剂,能够与氯化氢反应生成氯乙烷,则E为CH2=CH2,
(1)A的名称为乙醛;B为CH3COOH,含有的官能团为羧基(或-COOH);反应③为乙酸与乙醇发生酯化反应生成乙酸乙酯,该反应也属于取代反应;反应④为乙烯与氯化氢发生加成反应生成氯乙烷,
故答案为:乙醛;羧基(或-COOH); 酯化(或取代反应);加成反应;
(2)A的结构简式为:CH3CHO,E的结构简式为:CH2=CH2,
故答案为:CH3CHO; CH2=CH2;
(3)③为乙酸、乙醇的酯化反应,反应的方程式为CH3CH2OH+CH3COOH  CH3COOCH2CH3+H2O,
CH3COOCH2CH3+H2O,
反应④为乙烯与氯化氢发生加成反应生成氯乙烷,反应方程式为CH2=CH2+HCl CH3CH2Cl,
CH3CH2Cl,
故答案为:CH3CH2OH+CH3COOH  CH3COOCH2CH3+H2O;CH2=CH2+HCl
CH3COOCH2CH3+H2O;CH2=CH2+HCl CH3CH2Cl;
CH3CH2Cl;
(4)CH3COOCH2CH3的酯类物质的同分异构体有HCOOCH2CH2CH3 或HCOOCH(CH3)2等,故答案为:HCOOCH2CH2CH3 或HCOOCH(CH3)2.
点评 本题考查了有机推断,题目难度中等,熟练掌握常见有机物结构与性质为解答关键,注意明确常见有机物官能团名称、反应类型,能够正确书写常见有机反应方程式.

 香叶醇是合成玫瑰香油的主要原料,其结构简式如图:下列有关香叶醇的叙述不正确的是( )
香叶醇是合成玫瑰香油的主要原料,其结构简式如图:下列有关香叶醇的叙述不正确的是( )| A. | 香叶醇的分子式为C10H17O | |
| B. | 能使溴的四氯化碳溶液褪色 | |
| C. | 能使酸性高锰酸钾溶液褪色 | |
| D. | 既能发生加成反应也能发生取代反应 |
| A. | CO2、SO2都是酸性氧化物,都能使酸性高锰酸钾溶液褪色 | |
| B. | MgO、BaO都是离子化合物,熔化时都能导电 | |
| C. | CO2与SiO2化学式相似,则CO2与SiO2的物理性质也相似 | |
| D. | CuO、Fe2O3都是不溶于水的碱性氧化物,都是黑色粉末 |
| A. | 海水中蕴藏有丰富的资源,人类可以大量开发,以弥补资源的短缺 | |
| B. | 海水可以成为廉价的资源基地,但要合理开发,综合利用 | |
| C. | 可以用太阳能电解海水以获取氢能源 | |
| D. | 人类在利用海水时要兼顾海洋生物和海洋生态平衡 |
| b | |||||||||||||||||
| h | j | ||||||||||||||||
| a | c | f | i | l | m | ||||||||||||
| e | g | ||||||||||||||||
| d | k | ||||||||||||||||
(2)下表是一些气态基态原子的第一、二、三、四级电离能(kJ•mol-1):
| 锂 | X | Y | |
| 第一电离能 | 519 | 502 | 580 |
| 第二电离能 | 7296 | 4570 | 1820 |
| 第三电离能 | 11799 | 6920 | 2750 |
| 第四电离能 | 9550 | 11600 |
②表中Y可能为以上13种元素中的f(填写字母)元素.用元素符号表示X和j形成化合物的电子式
 .
.(3)根据构造原理,用电子排布式表示e的特征电子构型1s22s22p63s23p63d24s2
(4)以上13种元素中m(填写字母)元素原子失去核外第一个电子需要的能量最多.
| A. | 99 | B. | 67 | C. | 32 | D. | 166 |
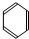 、C:CH3CH2OH D:CH3COOH
、C:CH3CH2OH D:CH3COOH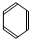 在FeBr3催化作用下,与液溴反应的化学方程式为:
在FeBr3催化作用下,与液溴反应的化学方程式为: .
.