题目内容
9.以沉淀法除去工业级偏钒酸铵(NH4VO3)中硅、磷元素杂质的流程如图1: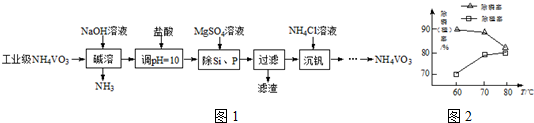
(1)碱熔时,下列措施有利于NH3逸出的是ac.
a.升温 b. 加压 c.增大NaOH溶液浓度
(2)滤渣主要成分为Mg3(PO4)2、MgSiO3,已知Ksp[Mg3(PO4)2]=6.4×10-26,Ksp(MgSiO3)=2.3×10-5.若滤液中c(PO${\;}_{4}^{3-}$)≤10-6 mol•L-1,则c(Mg2+)至少为4×10-5mol•L-1.
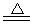
(3)由图可知,加入一定量的MgSO4溶液作沉淀剂.随着温度升高,除磷率下降,其原因是Mg3(PO4)2溶解度增大、升温促进Mg2+水解生成Mg(OH)2;随着温度升高,除硅率增大,其原因是SiO32-+2H2O
 H2SiO3↓+2OH-(或者SiO32-+3H2O
H2SiO3↓+2OH-(或者SiO32-+3H2O H4SiO4↓+2OH-)(用离子方程式表示).
H4SiO4↓+2OH-)(用离子方程式表示).(4)沉钒时,反应温度需控制在50℃,在实验室可采取的措施为50℃水浴加热.在此温度和pH=8的最佳条件下,探究NH4Cl的浓度对沉钒率的影响,设计实验步骤(常见试剂任选):取两份10mL一定浓度的滤液A和B,分别加入1mL和 10mL的1mol•L-1NH4Cl溶液,向向A中加入约9mL蒸馏水,使两份溶液总体积相等,控制两份溶液温度均为50℃、pH均为8,由专用仪器测定沉钒率.(忽略混合过程中溶液体积的变化)
(5)高纯的偏钒酸铵灼烧可制备新型光电材料V2O5,该反应的化学方程式为2NH4VO3$\frac{\underline{\;\;△\;\;}}{\;}$V2O5+2NH3↑+H2O.
分析 以沉淀法除去工业级偏钒酸铵(NH4VO3)中硅、磷元素杂质的流程为:在偏钒酸铵中加氢氧化钠溶液,将偏钒酸铵溶解,铵盐遇到强碱生成氨气,再加盐酸调节溶液的pH值,加硫酸镁,生成Mg3(PO4)2、MgSiO3沉淀,过滤除去滤渣,在滤液中加氯化铵得偏钒酸铵,
(1)根据气体在水中溶解度的影响因素可知,升温、减压都可以减小气体的溶解度,由于氨气在水中形成氨水能电离出氢氧根离子,根平衡移动原理,增加氢氧根浓度可以减小氨气 的溶解度,据此答题;
(2)根据Ksp[Mg3(PO4)2]=c3(Mg2+)c2(PO43-),结合c(PO${\;}_{4}^{3-}$)≤10-6 mol•L-1进行计算;
(3)根据影响盐类水解的因素可知,升高温度水解程度增大,镁离子、硅酸根离子都是易水解的离子;
(4)反应温度需控制在50℃可以用水浴,探究NH4Cl的浓度对沉钒率的影响,为要有可比性,两溶液的体积必须相等;
(5)高纯的偏钒酸铵灼烧生成V2O5,根据元素守恒可知,还应有氨气和水产生,据此书写化学方程式;
解答 解:以沉淀法除去工业级偏钒酸铵(NH4VO3)中硅、磷元素杂质的流程为:在偏钒酸铵中加氢氧化钠溶液,将偏钒酸铵溶解,铵盐遇到强碱生成氨气,再加盐酸调节溶液的pH值,加硫酸镁,生成Mg3(PO4)2、MgSiO3沉淀,过滤除去滤渣,在滤液中加氯化铵得偏钒酸铵,
(1)根据气体在水中溶解度的影响因素可知,升温、减压都可以减小气体的溶解度,故选a,由于氨气在水中形成氨水能电离出氢氧根离子,根平衡移动原理,增加氢氧根浓度可以减小氨气 的溶解度,故选c,
故答案为:ac;
(2)根据Ksp[Mg3(PO4)2]=c3(Mg2+)c2(PO43-)可知,当c(PO${\;}_{4}^{3-}$)=10-6 mol•L-1时,c(Mg2+)=$\root{3}{\frac{6.4×10{\;}^{-26}}{(1{0}^{-6})^{2}}}$=4×10-5mol•L-1,
故答案为:4×10-5;
(3)根据影响盐类水解的因素可知,升高温度水解程度增大,镁离子、硅酸根离子都是易水解的离子,所以升温促进Mg2+水解生成Mg(OH)2,使硅酸根水解生成硅沉淀,反应的离子方程式为SiO32-+2H2O

故答案为:升温促进Mg2+水解生成Mg(OH)2;SiO32-+2H2O

(4)反应温度需控制在50℃可以用水浴加热,探究NH4Cl的浓度对沉钒率的影响,为要有可比性,两溶液的体积必须相等,所以要 向A中加入约9 mL蒸馏水,使两份溶液总体积相等,
故答案为:50℃水浴加热;向A中加入约9 mL蒸馏水,使两份溶液总体积相等;
(5)高纯的偏钒酸铵灼烧生成V2O5,根据元素守恒可知,还应有氨气和水产生,反应的化学方程式为2NH4VO3$\frac{\underline{\;\;△\;\;}}{\;}$V2O5+2 NH3↑+H2O,
故答案为:2NH4VO3$\frac{\underline{\;\;△\;\;}}{\;}$V2O5+2 NH3↑+H2O.
点评 本题考查了制备实验方案的设计,涉及到氧化还原反应、盐类的水解原理的应用、实验方案的完善等,难度中等,侧重对学生分析问题的能力考查.

| A. | 二者溶液中的pH前者大 | |
| B. | 后者仅存在水解平衡,不存在电离平衡 | |
| C. | 两溶液中均存在c(Na+)+c(H+)=c(HCO${\;}_{3}^{-}$)+2c(CO${\;}_{3}^{2-}$)+c(OH-) | |
| D. | 分别加入NaOH固体,恢复到原温度,c(CO${\;}_{3}^{2-}$)前者增大后者减小 |
| A. | 这种软锰矿石中MnO2的质量分数为75% | |
| B. | 被氧化的HCl的物质的量为4mol | |
| C. | 参加反应的HCl的质量为146g | |
| D. | 被还原的MnO2的物质的量为1mol |
| A. | NaCl(饱和溶液)$\stackrel{NH_{3}、CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| B. | Al2O3$\stackrel{盐酸}{→}$AlCl3(aq)$\stackrel{电解}{→}$Al | |
| C. | S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| D. | CuSO4(aq)$\stackrel{NaOH(aq)}{→}$Cu(OH)2悬浊液$→_{△}^{葡萄糖}$Cu |
| A. | Na+、SO42-、HCO3- | B. | NH4+、SO42-、NO3- | C. | Cu2+、ClO-、NO3- | D. | K+、OH-、Cl- |
| A. | 若有16 g Br2生成,则反应过程中转移了0.2 mol电子 | |
| B. | Cl2是氧化剂 | |
| C. | NaBr发生了还原反应 | |
| D. | NaCl为还原产物 |
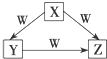 X、Y、Z、W是中学化学常见的四种物质,它们之间具有如图所示转化关系,则下列组合不可能的是:
X、Y、Z、W是中学化学常见的四种物质,它们之间具有如图所示转化关系,则下列组合不可能的是:| X | Y | Z | W | |
| A | NaOH | Na2CO3 | NaHCO3 | CO2 |
| B | O2 | CO2 | CO | C |
| C | AlCl3 | Al(OH)3 | NaAlO2 | NaOH |
| D | S | SO2 | SO3 | O2 |
| A. | A | B. | B | C. | C | D. | D |
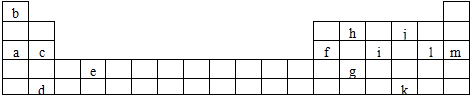
(1)上述元素的单质可能是电的良导体的是a c d e f h(填字母代号).
(2)下表是一些气态基态原子的第一、二、三、四级电离能(kJ•mol-1):
| 锂 | X | Y | |
| 第一电离能 | 519 | 502 | 580 |
| 第二电离能 | 7296 | 4570 | 1820 |
| 第三电离能 | 11799 | 6920 | 2750 |
| 第四电离能 | 9550 | 11600 |
②表中Y可能为以上13种元素中的Al(填元素符号)元素.用元素符号表示a和j形成化合物的电子式是
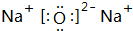 和
和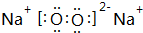 .
.(3)写出元素e的电子排布式1s22s22p63s23p63d24s2.
(4)以上13种元素中,Ar(填元素符号)元素原子失去核外第一个电子需要的能量最多.
(5)根据元素原子的外围电子排布的特征,可将元素周期表分成几个区域,其中,元素c、m分别位于s区、p区.
