题目内容
1.对于2NaBr+Cl2═2NaCl+Br2反应,下列说法错误的是( )| A. | 若有16 g Br2生成,则反应过程中转移了0.2 mol电子 | |
| B. | Cl2是氧化剂 | |
| C. | NaBr发生了还原反应 | |
| D. | NaCl为还原产物 |
分析 Cl2+2NaBr═Br2+2NaCl中,Cl元素的化合价降低,Br元素的化合价升高,以此来解答.
解答 解:A.16gBr2物质的量为0.1mol,Br2~Br-~2e-反应过程中转移了0.2NA个电子,故A正确;
B.Cl元素的化合价降低,则Cl2为氧化剂,故B正确;
C.Br元素的化合价升高,则NaBr为还原剂,发生氧化反应,故C产物;
D.Cl元素的化合价降低,则Cl2为氧化剂,NaCl为还原产物,故D正确;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,注意从化合价角度分析,侧重基本概念的考查,题目难度不大.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
11.下列物质不能用水加以鉴别的是( )
| A. | 苯和四氯化碳 | B. | 氢氧化钠固体和食盐 | ||
| C. | 石灰石和重晶石 | D. | 酒精和汽油 |
12.下列说法正确的是( )
| A. | 铝有较高熔点,可做耐火材料 | |
| B. | SO2能使溴水褪色,体现其漂白性 | |
| C. | 氨气是电解质,因为氨气的水溶液能导电 | |
| D. | 钠钾合金可用于快中子反应堆的热交换剂 |
16.下列有关实验操作正确的是( )
| A. |  除去Cl2中的HCl 除去Cl2中的HCl | B. | 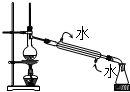 制备蒸馏水 制备蒸馏水 | ||
| C. |  萃取碘水中碘 萃取碘水中碘 | D. |  称量氢氧化钠固体 称量氢氧化钠固体 |
13.下列有关化学用语表达正确的是( )
| A. | 质子数为92、中子数为146的U原子:${\;}_{92}^{146}$U | |
| B. | HClO的结构式:H-Cl-O | |
| C. | HF的电子式: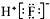 | |
| D. | 35Cl-和37Cl-离子结构示意图均可以表示为: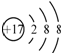 |
10.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 129C60中含有NA个电子 | |
| B. | 46g NO2和N2O4的混合气体含有的原子数为3NA | |
| C. | 标准状况下,22.4L CCl4所含的分子数为6.02×1023 | |
| D. | 100mL0.1mol/LCaCl2溶液中Cl-的物质的量浓度为0.01mol/L |
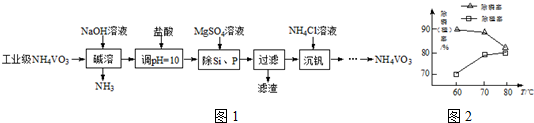
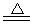 H2SiO3↓+2OH-(或者SiO32-+3H2O
H2SiO3↓+2OH-(或者SiO32-+3H2O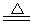 H4SiO4↓+2OH-)(用离子方程式表示).
H4SiO4↓+2OH-)(用离子方程式表示). 根据如图回答问题:
根据如图回答问题: