题目内容
20.取软锰矿石(主要成分为MnO2)116g 跟足量浓盐酸发生如下反应(杂质不参与反应)MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,制得22.4L Cl2(标准状况).下列有关说法中不正确的是( )| A. | 这种软锰矿石中MnO2的质量分数为75% | |
| B. | 被氧化的HCl的物质的量为4mol | |
| C. | 参加反应的HCl的质量为146g | |
| D. | 被还原的MnO2的物质的量为1mol |
分析 n(Cl2)=$\frac{22.4L}{22.4L/mol}$=1mol,由MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O反应,1molMnO2参加反应,反应中Mn元素的化合价降低,Cl元素的化合价升高,以此来解答.
解答 解:A.n(Cl2)=$\frac{22.4L}{22.4L/mol}$=1mol,由MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O反应,1molMnO2参加反应,其质量为87g,则软锰矿石中MnO2的质量分数为$\frac{87g}{116g}$×100%=75%,故A正确;
B.由反应可知,生成1mol气体时,2molHCl被氧化,故B错误;
C.参加反应的HCl为4mol,其质量为4mol×36.5g/mol=146g,故C正确;
D.Mn元素的化合价降低,被还原的MnO2的物质的量为1mol,故D正确;
故选B.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
11.下列物质不能用水加以鉴别的是( )
| A. | 苯和四氯化碳 | B. | 氢氧化钠固体和食盐 | ||
| C. | 石灰石和重晶石 | D. | 酒精和汽油 |
8.下列反应不属于氧化还原反应的是( )
| A. | 铝片与稀盐酸的反应 | B. | Ca(OH)2与NH4Cl的反应 | ||
| C. | 灼热的炭与CO2的反应 | D. | 甲烷在氧气中的燃烧反应 |
15.下列实验操作正确的是( )
| A. | 用酒精萃取碘水中的碘 | |
| B. | 蒸馏时,应使温度计水银球伸入蒸馏烧瓶内液面下 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中一定不含有K+ |
5.下列电离方程式错误的是( )
| A. | CaCl2=Ca2++2Cl- | B. | Na2SO4=Na++2SO42- | ||
| C. | HNO3=H++NO${\;}_{3}^{-}$ | D. | Na2CO3=2Na++CO32 |
12.下列说法正确的是( )
| A. | 铝有较高熔点,可做耐火材料 | |
| B. | SO2能使溴水褪色,体现其漂白性 | |
| C. | 氨气是电解质,因为氨气的水溶液能导电 | |
| D. | 钠钾合金可用于快中子反应堆的热交换剂 |
10.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 129C60中含有NA个电子 | |
| B. | 46g NO2和N2O4的混合气体含有的原子数为3NA | |
| C. | 标准状况下,22.4L CCl4所含的分子数为6.02×1023 | |
| D. | 100mL0.1mol/LCaCl2溶液中Cl-的物质的量浓度为0.01mol/L |
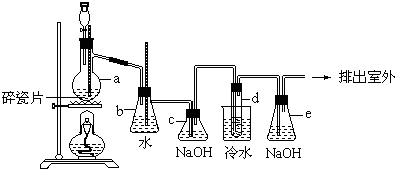
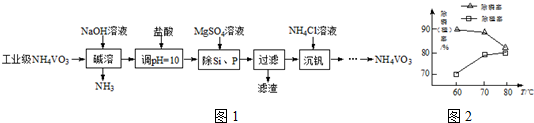
 H2SiO3↓+2OH-(或者SiO32-+3H2O
H2SiO3↓+2OH-(或者SiO32-+3H2O H4SiO4↓+2OH-)(用离子方程式表示).
H4SiO4↓+2OH-)(用离子方程式表示).