题目内容
【题目】硼及其化合物应用广泛。回答下列问题:
(1)基态B原子的价电子轨道表达式为____________________________,其第一电离能比Be ____________(填“大”或“小”)
(2)氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是______________。
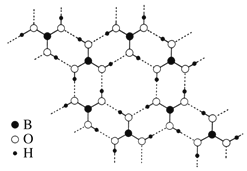
(3)常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如图。
①B原子的杂化方式为_____________。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:________________________________________________________。
② 路易斯酸碱理论认为,任何可接受电子对的分子或离子叫路易斯酸,任何可给出电子对的分子或离子叫路易斯碱。从结构角度分析硼酸是路易斯酸的原因是_______________________________。
【答案】 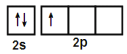 小 N sp2 硼酸分子间通过氢键缔合,加热时,部分氢键被破坏 硼酸分子中B原子有一个2p空轨道
小 N sp2 硼酸分子间通过氢键缔合,加热时,部分氢键被破坏 硼酸分子中B原子有一个2p空轨道
【解析】试题分析:本题考查价电子轨道表示式的书写,第一电离能的比较,配位键,杂化方式的判断,氢键的应用。
(1)B的原子序数为5,B原子核外有5个电子,基态B原子核外电子排布式为1s22s22p1,价电子排布式为2s22p1,价电子轨道表示式为![]() 。Be的价电子排布式为2s2,较稳定,B的第一电离能比Be小。
。Be的价电子排布式为2s2,较稳定,B的第一电离能比Be小。
(2)氨硼烷的结构式为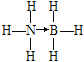 ,B原子具有空轨道,N原子有孤电子对,N提供孤电子对与B共用,提供孤电子对的成键原子是N。
,B原子具有空轨道,N原子有孤电子对,N提供孤电子对与B共用,提供孤电子对的成键原子是N。
(3)①根据结构,每个B原子形成3个硼氧σ键且B上没有孤电子对,B原子的杂化方式为sp2杂化。根据结构,常温常压下H3BO3分子间通过氢键缔合,由于氢键具有饱和性,H3BO3分子难与H2O分子间形成氢键;加热时部分H3BO3分子间氢键被破坏,H3BO3分子与水分子间形成氢键,所以硼酸在冷水中的溶解度小而加热时溶解度增大。
②H3BO3分子中B原子有一个2p空轨道,能接受电子对,根据路易斯酸碱理论,硼酸是路易斯酸。

【题目】科学家正在研究温室气体CH4和CO2的转化和利用。请回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用____________形象化描述。在基态14C原子中,核外存在___________对自旋相反的电子。
(2)CH4和CO2所含的三种元素电负性从小到大的顺序为__________________________。
(3)一定条件下,CH4和CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物俗称“可燃冰”。
参数 分子 | 分子直径/nm | 分子与H2O的结合能E/kJ·mol-1 |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |

①下列关于CH4和CO2的说法正确的是________(填序号)。
a.CO2分子中含有2个σ键和2个π键
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d.CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0. 586 nm,根据上述图表所提供的数据分析,提出该设想的依据是______________________________________。
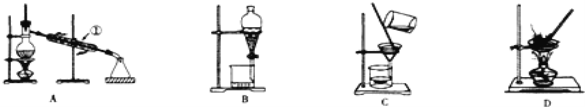
【题目】硫代硫酸钠(Na2S2O3·5H2O) 俗名“大苏打”。易溶于水,难溶于乙醇,沸点为100℃,酸性或加热条件下易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:

回答下列问题:
(1)装置A可用于观察SO2的生成速率,其中的液体最好选择_____________(填序号)。若装置堵塞使气流不畅,则A中的现象为_______________________________。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(2)尾气处理可以选择以下装置中的________(填序号)。

(3)反应过程中若pH值小于7则会降低产率,请用离子方程式解释原因:_________________________。
(4)请写出装置C中发生反应的化学方程式:_________________________。
(5)反应结束后,取C中混合物趁热过滤,取滤液于蒸发皿中, ______________,抽滤,洗涤,低温下干燥得产品。洗涤时要尽量减少产品的损失,其具体操作是_________________________。
(6)为检验制得的产品的纯度,该实验小组称取4g 的产品配制成250mL 硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入20mL 0.0lmol·L-1KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配的Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+ S4O62-,实验数据如下表:
实验序号 | 1 | 2 | 3 |
Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.2 |
当滴入最后一滴Na2S2O3溶液时,溶液___________,且半分钟内不变化,则达到终点。计算该产品的纯度是____________________________。