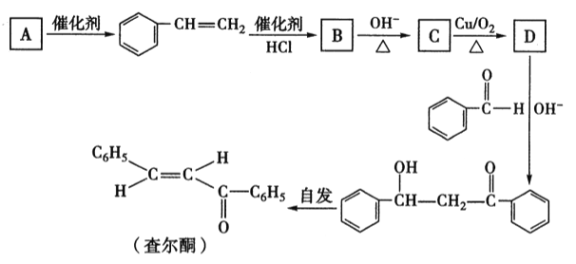
题目内容
【题目】(1)A、B、C三种无色可溶性盐分别是由Na+、Ag+、Ba2+、Cl-、NO![]() 、CO
、CO![]() 中不同的阴、阳离子组成。经实验验证知:A溶液、B溶液均可以与盐酸反应,其中A产生白色沉淀,B产生气泡。则A为_______、B为_________。将B和C的溶液混合后,发生反应的离子方程式为________________。
中不同的阴、阳离子组成。经实验验证知:A溶液、B溶液均可以与盐酸反应,其中A产生白色沉淀,B产生气泡。则A为_______、B为_________。将B和C的溶液混合后,发生反应的离子方程式为________________。
(2)有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验:

从实验可以判断,该固体粉末中一定不含有____________,它的组成可能是__________或_____________。
【答案】AgNO3 Na2CO3 Ba2++CO32-=BaCO3↓ CuSO4 CaCO3、Na2SO4、KNO3 CaCO3、BaCl2、KNO3
【解析】
(1)由离子共存可知,Ag+只能结合NO3-形成硝酸银、剩下的离子中Ba2+只能结合Cl-形成氯化钡、最后的离子结合形成碳酸钠,然后根据A、B能够与盐酸反应的现象判断A、B组成,从而明确A、B、C的名称,书写B和C的溶液混合反应的化学方程式。
(2)固体粉CaCO3、Na2SO4、BaCl2、CuSO4溶于水有沉淀、无色溶液,则能排除CuSO4,因为CuSO4溶于水显蓝色;难溶物溶于稀盐酸产生无色气体,说明一定含有碳酸钙,硫酸钠和氯化钡不会同时存在。
(1)A、B、C为三种无色可溶盐,则Ag+只能结合NO3-形成AgNO3、剩下的离子中Ba2+只能结合Cl-形成BaCl2,另一种物质则为Na2CO3;A溶液、B溶液均可与盐酸反应,其中A产生白色沉淀,则A为AgNO3;B与盐酸产生气泡,所以B为Na2CO3,C不与盐酸反应,则C为BaCl2,将B和C的溶液混合反应的化学方程式为:BaCl2+Na2CO3=BaCO3↓+2NaCl,反应的离子方程式为Ba2++CO32-=BaCO3↓;故答案为:AgNO3;Na2CO3;Ba2++CO32-=BaCO3↓;
(2)有一包固体粉末由CaCO3、Na2SO4、BaCl2、CuSO4中的两种物质组成,取样品加水,出现白色沉淀,该白色沉淀能够溶于稀盐酸产生无色气体,则该固体粉末中一定含有CaCO3,且硫酸钠与氯化钡不会同时存在;得到无色溶液,该固体粉末中一定不含有CuSO4,因为CuSO4溶于水显蓝色,根据分析可知,溶液中一定不存在CuSO4,该固体粉末含有的三种物质可能为:CaCO3、Na2SO4、KNO3或CaCO3、BaCl2、KNO3,故答案为:CuSO4;CaCO3、Na2SO4、KNO3;CaCO3、BaCl2、KNO3。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案【题目】“废气”的综合处理与应用技术是科研人员的重要研究课题,CO、SO2、NO2是重要的大气污染气体。
(1)处理后的CO是制取新型能源二甲醚(CH3OCH3)的原料。
已知①CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1=-41.0 kJ/mol
CO2(g)+H2(g) ΔH1=-41.0 kJ/mol
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-49.0 kJ/mol
CH3OH(g)+H2O(g) ΔH2=-49.0 kJ/mol
③CH3OCH3(g)+H2O(g)![]() 2CH3OH(g) ΔH3=+23.5 kJ/mol
2CH3OH(g) ΔH3=+23.5 kJ/mol
则反应2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g)的△H=________.
CH3OCH3(g)+H2O(g)的△H=________.
(2)已知973 K时,SO: 与NO2 反应生成SO,和NO,将混合气体经冷凝分离出的SO,可用于制备硫酸。
①973 K时,测得:
NO2(g)![]() NO(g)+ 1/2O2(g) K1=0.018;
NO(g)+ 1/2O2(g) K1=0.018;
SO2(g)+1/2O2(g)![]() SO3(g) K2=20;
SO3(g) K2=20;
则反应SO2(g)+NO2(g)![]() SO3(g)+NO(g)的K3=________
SO3(g)+NO(g)的K3=________
②973K时,向容积为2 L的密闭容器中充人SO2、NO2 各0.2mol。平衡时SO2的转化率为________。
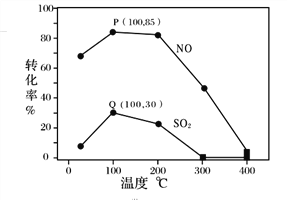
③恒压下,SO2的分压PSO2随温度的变化如图所示:

当温度升高时,SO2(g)+NO2(g)![]() SO3(g)+NO(g)的化学平衡常数_____(填“增大”或“减小”), 判断理由 是_________.
SO3(g)+NO(g)的化学平衡常数_____(填“增大”或“减小”), 判断理由 是_________.
(3)用纳米铁可去除污水中的NO3-。
①纳米铁粉与水中NO3-反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O。研究发现,若PH偏低将会导致NO3-的去除率下降,其原因是___________.
②相同条件下,纳米铁粉去除不同水样中的NO3-的速率有较大差异。
下表中Ⅰ和Ⅱ产生差异的原因可能是____;Ⅱ中0~20min,用NO3-表示的平均反应速率为____mol·L-l·min-1。
反应时间/min | 0 | 10 | 20 | 30 | 40 | |
Ⅰ | c(NO3-)/10-4 mol/L | 8 | 3.2 | 1.6 | 0.8 | 0.64 |
Ⅱ | c(NO3-)/10-4 mol/L (含少量Cu2+) | 8 | 0.48 | 0.32 | 0.32 | 0.32 |
(4)用NaOH溶液吸收SO2可得NaHSO3溶液,对NaHSO3溶液中各离子浓度的关系,下列分析不合理的是___。(已知常温下K1(H2SO3)=1.5×10-2,,K2(H2SO3)=1.02×10-7)
A.[Na+]+[H+]=[HSO3-]+2[SO32-]+[OH-]
B.[Na+]=[HSO3-]+[SO32-]+[H2SO3]
C.[Na+]>[SO32-]>[HSO3-]>[OH-]>[H+]
D.[H+]+[SO32-]=[OH-]+[H2SO3]