题目内容
1.某饱和一元醛和饱和一元酮的混合物共0.1mol,质量为5.8g,此混合物和足量的银氨溶液发生银镜反应可析出8.64g银,则该混合物中的醛是( )| A. | HCHO | B. | CH3CHO | C. | CH3CH2CHO | D. | CH3CH2CH2CHO |
分析 某饱和一元醛和饱和一元酮的混合物共0.1mol,质量为5.8g,混合物的平均摩尔质量为:$\frac{5.8g}{0.1mol}$=58g/mol,饱和一元酮碳原子数最小的为丙酮,其相对分子质量为58,故该饱和一元醛的相对分子质量≤58,可能为甲醛、乙醛和丙醛;析出银的物质的量为:$\frac{8.64g}{108g/mol}$=0.08mol,若是乙醛、丙醛,根据R-CHO~2Ag可知乙醛、丙醛的物质的量,再根据总物质的量、总质量计算出对应酮的摩尔质量;若饱和一元醛是甲醛,根据关系式H-CHO~4Ag计算出甲醛的物质的量,计算出酮的摩尔质量,进而确定混合物的组成.
解答 解:某饱和一元醛和饱和一元酮的混合物共0.1mol,质量为5.8g,混合物的平均摩尔质量为:$\frac{5.8g}{0.1mol}$=58g/mol,饱和一元酮碳原子数最小的为丙酮,其相对分子质量为58,故该饱和一元醛的相对分子质量≤58,可能为甲醛、乙醛和丙醛;析出银的物质的量为:$\frac{8.64g}{108g/mol}$=0.08mol,
若是乙醛,根据R-CHO~2Ag可知乙醛的物质的量为0.04mol,质量为:0.04mol×44g/mol=1.76g,则酮的物质的量为0.1mol-0.04mol=0.06mol,酮的质量为:5.8g-1.76g=4.04g,则酮的摩尔质量为:$\frac{4.04g}{0.06mol}$=67.3g/mol,不存在该酮;
假设饱和一元醛是甲醛,则H-CHO~4Ag,则甲醛的物质的量为0.02mol,质量为:0.02mol×30g/mol=0.6g,酮的物质的量为0.1mol-0.02mol=0.08mol,酮的质量为:5.8g-0.6g=5.2g,酮的摩尔质量为:$\frac{5.2g}{0.08g}$=65g/mol,不存在该酮;
若为丙醛,根据R-CHO~2Ag可知丙醛的物质的量为0.04mol,质量为:0.04mol×58g/mol=2.32g,酮的质量为:5.8g-2.32g=3.48g,物质的量为:0.1mol-0.04mol=0.06mol,该酮的摩尔质量为:$\frac{3.48g}{0.06mol}$=58g/mol,为丙醛,
根据分析可知,该混合物为丙醛和丙酮,
故选C.
点评 本题考查了混合物反应的计算,题目难度中等,明确醛类的性质及与银的反应关系式为解答关键,试题侧重考查学生的分析、理解能力及化学计算能力.

| A. | 此电池工作时会发出蓝色火焰 | |
| B. | 燃料电池具有能量转化率高、可持续使用的优点 | |
| C. | 该电池的负极电极反应式为:2H2+4e-═4H+ | |
| D. | 该电池的正极电极反应式为:O2+2H2O+4e-═4OH- |
| A. | H2O、CO | B. | MgF2、H2O | C. | KOH、Mg(OH)2 | D. | HCl、HBr |
| A. | 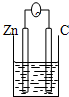 稀硫酸 | B. | 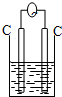 AgNO3(aq) | C. | 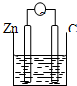 蔗糖 | D. | 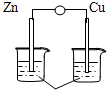 稀硫酸 |
| A. | X的原子序数比Y小 | B. | X原子的最外层电子数比Y大 | ||
| C. | X的原子半径比Y大 | D. | X元素的最高正价比Y大 |
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将某溶液与稀盐酸反应产生的气体通入澄清石灰水 | 石灰水变浑浊 | 该溶液中一定含有CO32- |
| B | 常温下,将铁片浸入足量浓硫酸中 | 铁片不溶解 | 常温下,铁与浓硫酸一定没有发生化学反应 |
| C | 向某食盐溶液中滴加淀粉溶液 | 溶液颜色不变 | 该实验中一定没有添加KIO3 |
| D | 向苯酚钠溶液滴加乙酸溶液 | 溶液变浑浊 | 相同条件下,乙酸的酸性一定比苯酚强 |
| A. | A | B. | B | C. | C | D. | D |
| A. | C、H、O | B. | F、Cl、Br | C. | Li、Be、B | D. | Si、S、P |
| A. | 活性炭、吸附剂 | B. | KMnO4、氧化剂 | C. | 氯化钠、干燥剂 | D. | 硅胶、干燥剂 |